Ang mga lawas sa ketone gihimo sa atay ug gigamit ingon usa ka gigikanan sa enerhiya kung ang glucose dili dali makuha sa lawas sa tawo. Ang duha ka nag-unang mga lawas sa ketone mao ang acetoacetate (AcAc) ug 3-beta-hydroxybutyrate (3HB), samtang ang acetone mao ang ikatulo ug labing gamay nga abunda, ketone nga lawas. Ang mga ketones kanunay anaa sa dugo ug ang lebel niini motaas sa panahon sa pagpuasa ug dugay nga ehersisyo.�Ketogenesis mao ang biochemical nga proseso diin ang mga organismo makahimo og ketone nga mga lawas pinaagi sa pagkahugno sa mga fatty acid ug ketogenic amino acids.
Ang mga lawas sa ketone kasagarang namugna sa mitochondria sa mga selula sa atay. Ang ketogenesis mahitabo kung adunay ubos nga lebel sa glucose sa dugo, labi na pagkahuman sa ubang mga tindahan sa cellular carbohydrate, sama sa glycogen, nahurot. Kini nga mekanismo mahimo usab nga mahitabo kung adunay dili igo nga kantidad sa insulin. Ang paghimo sa mga lawas sa ketone sa katapusan gisugdan aron magamit ang enerhiya nga gitipigan sa lawas sa tawo ingon mga fatty acid. Ang ketogenesis mahitabo sa mitochondria diin kini independente nga gi-regulate.
Kaundan
abstract
Ang metabolismo sa lawas sa Ketone usa ka sentro nga node sa physiological homeostasis. Niini nga pagrepaso, atong hisgutan kung giunsa ang mga ketones nagsilbi nga discrete fine-tuning metabolic roles nga nag-optimize sa performance sa organ ug organismo sa lain-laing nutrient nga nagpabilin ug nanalipod gikan sa panghubag ug kadaot sa daghang mga organ system. Tradisyonal nga gitan-aw isip metabolic substrates nga gilista lamang sa carbohydrate restriction, ang bag-o nga mga obserbasyon nagpasiugda sa importansya sa ketone nga mga lawas isip importante nga metabolic ug signaling mediators kung ang carbohydrates abunda. Nagdugang sa usa ka repertoire sa nahibal-an nga mga opsyon sa terapyutik alang sa mga sakit sa sistema sa nerbiyos, ang mga umaabot nga papel alang sa mga lawas sa ketone sa kanser mitungha, ingon nga adunay makaiikag nga mga tahas sa pagpanalipod sa kasingkasing ug atay, nagbukas sa mga kapilian sa pagtambal sa sakit nga may kalabutan sa katambok ug cardiovascular. Ang mga kontrobersiya sa metabolismo sa ketone ug pagsenyas gihisgutan aron mapasig-uli ang klasikal nga dogma sa mga kontemporaryong obserbasyon.
Pasiuna
Ang mga lawas sa ketone usa ka hinungdanon nga alternatibong gigikanan sa sugnod sa metaboliko alang sa tanan nga mga dominyo sa kinabuhi, eukarya, bakterya, ug archaea (Aneja et al., 2002; Cahill GF Jr, 2006; Krishnakumar et al., 2008). Ang metabolismo sa lawas sa ketone sa mga tawo gigamit aron masunog ang utok sa mga yugto sa kakulang sa sustansya. Ang mga lawas sa ketone nalambigit sa hinungdanon nga mga agianan sa metaboliko sa mammalian sama sa ?-oxidation (FAO), ang tricarboxylic acid cycle (TCA), gluconeogenesis, de novo lipogenesis (DNL), ug biosynthesis sa sterols. Sa mga mammal, ang mga lawas sa ketone kasagarang gihimo sa atay gikan sa acetyl-CoA nga nakuha sa FAO, ug kini gidala sa extrahepatic nga mga tisyu alang sa terminal nga oksihenasyon. Kini nga pisyolohiya naghatag og alternatibong sugnod nga gipadako sa medyo mubu nga mga panahon sa pagpuasa, nga nagdugang sa fatty acid nga anaa ug nagpamenos sa carbohydrate availability (Cahill GF Jr, 2006; McGarry ug Foster, 1980; Robinson ug Williamson, 1980). Ang oksihenasyon sa lawas sa ketone nahimong usa ka mahinungdanong kontribusyon sa kinatibuk-ang metabolismo sa enerhiya sa mammalian sulod sa extrahepatic nga mga tisyu sa daghang mga kahimtang sa pisyolohikal, lakip ang pagpuasa, kagutom, panahon sa neonatal, post-ehersisyo, pagmabdos, ug pagsunod sa mga diyeta nga ubos ang carbohydrate. Ang sirkulasyon nga kinatibuk-ang konsentrasyon sa lawas sa ketone sa himsog nga hamtong nga mga tawo kasagarang nagpakita sa circadian oscillations tali sa gibana-bana nga 100-250 �M, mosaka ngadto sa ~1 mM human sa dugay nga ehersisyo o 24h sa pagpuasa, ug mahimong matigom ngadto sa taas nga 20 mM sa pathological states sama sa diabetic ketoacidosis. Cahill GF Jr, 2006; Johnson et al., 1969b; Koeslag et al., 1980; Robinson ug Williamson, 1980; Wildenhoff et al., 1974). Ang atay sa tawo naggama ug hangtod sa 300 g nga mga lawas sa ketone kada adlaw (Balasse ug Fery, 1989), nga nag-amot tali sa 5-20% sa kinatibuk-ang gasto sa enerhiya sa gipakaon, gipuasa, ug gigutom nga mga estado (Balasse et al., 1978; Cox et. al., 2016).
Ang mga bag-ong pagtuon karon nagpasiugda sa mga kinahanglanon nga papel alang sa mga lawas sa ketone sa metabolismo sa selula sa mammalian, homeostasis, ug pagsenyas sa ilawom sa usa ka halapad nga lainlaing mga kahimtang sa physiological ug pathological. Gawas sa pagsilbi nga mga sugnod sa enerhiya alang sa extrahepatic nga mga tisyu sama sa utok, kasingkasing, o kaunuran sa kalabera, ang mga lawas sa ketone adunay hinungdanon nga papel ingon mga tigpataliwala sa signal, mga drayber sa pagbag-o sa post-translational (PTM), ug mga modulator sa panghubag ug oxidative stress. Niini nga pagrepaso, naghatag kami sa klasikal ug moderno nga mga panglantaw sa pleiotropic nga mga papel sa mga lawas sa ketone ug sa ilang metabolismo.
Kinatibuk-ang Pagsusi sa Metabolismo sa Lawas sa Ketone
Ang rate sa hepatic ketogenesis gidumala sa usa ka orkestra nga serye sa physiological ug biochemical nga pagbag-o sa tambok. Ang mga nag-unang regulators naglakip sa lipolysis sa fatty acids gikan sa triacylglycerols, transport ngadto ug tabok sa hepatocyte plasma membrane, transport ngadto sa mitochondria pinaagi sa carnitine palmitoyltransferase 1 (CPT1), ang ?-oxidation spiral, TCA cycle activity ug intermediate concentrations, redox potential, ug ang hormonal regulators niini nga mga proseso, kasagaran glucagon ug insulin [gisusi sa (Arias et al., 1995; Ayte et al., 1993; Ehara et al., 2015; Ferre et al., 1983; Kahn et al., 2005; McGarry ug Foster. , 1980; Williamson et al., 1969). Ang klasikal nga ketogenesis gitan-aw isip spillover pathway, diin ang ?-oxidation-derived acetyl-CoA milapas sa citrate synthase activity ug/o oxaloacetate nga anaa alang sa condensation aron mahimong citrate. Ang tulo ka carbon intermediate nagpakita sa anti-ketogenic nga kalihokan, lagmit tungod sa ilang abilidad sa pagpalapad sa oxaloacetate pool alang sa acetyl-CoA nga pagkonsumo, apan ang hepatic acetyl-CoA nga konsentrasyon lamang wala magtino sa ketogenic rate (Foster, 1967; Rawat ug Menahan, 1975; Williamson ug uban pa, 1969). Ang regulasyon sa ketogenesis pinaagi sa hormonal, transcriptional, ug post-translational nga mga panghitabo dungan nga nagsuporta sa ideya nga ang mga mekanismo sa molekula nga maayo nga tune sa ketogenic rate nagpabilin nga dili hingpit nga nasabtan (tan-awa ang Regulasyon sa HMGCS2 ug SCOT / OXCT1).
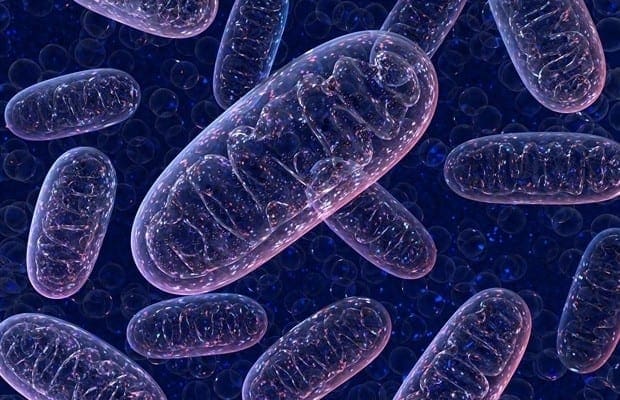
Ang ketogenesis nag-una sa hepatic mitochondrial matrix sa mga rate nga proporsyonal sa kinatibuk-ang fat oxidation. Human sa pagdala sa mga kadena sa acyl tabok sa mitochondrial membranes ug ?-oxidation, ang mitochondrial isoform sa 3-hydroxymethylglutaryl-CoA synthase (HMGCS2) nag-catalyze sa kapalaran nga naghimo sa condensation sa acetoacetyl-CoA (AcAc-CoA) ug acetyl-CoA aron makamugna og HMG-CoA. (Fig. 1A). Ang HMG-CoA lyase (HMGCL) nagbuak sa HMG-CoA sa pagpalingkawas sa acetyl-CoA ug acetoacetate (AcAc), ug ang naulahi gikunhoran ngadto sa d-?-hydroxybutyrate (d-?OHB) pinaagi sa phosphatidylcholine-dependent mitochondrial d-?OHB dehydrogenase ( BDH1) sa usa ka NAD + / NADH nga giubanan sa hapit nga balanse nga reaksyon (Bock ug Fleischer, 1975; LEHNINGER et al., 1960). Ang BDH1 equilibrium constant pabor sa d-?OHB production, apan ang ratio sa AcAc/d-?OHB ketone nga mga lawas direkta nga proporsyonal sa mitochondrial NAD + / NADH ratio, ug sa ingon ang BDH1 oxidoreductase nga kalihokan modulates mitochondrial redox potensyal (Krebs et al., 1969; Williamson et al., 1967). Ang AcAc mahimo usab nga kusang mag-decarboxylate ngadto sa acetone (Pedersen, 1929), ang tinubdan sa matam-is nga baho sa mga tawo nga nag-antos sa ketoacidosis (ie, kinatibuk-ang serum ketone nga lawas > ~7 mM; AcAc pKa 3.6, ?OHB pKa 4.7). Ang mga mekanismo diin ang mga lawas sa ketone gidala tabok sa mitochondrial inner membrane wala mahibal-an, apan ang AcAc / d-?OHB gipagawas gikan sa mga selyula pinaagi sa mga transporter nga monocarboxylate (sa mga mammal, MCT 1 ug 2, nailhan usab nga solute carrier 16A nga mga miyembro sa pamilya 1 ug 7) ug gidala sa sirkulasyon ngadto sa extrahepatic nga mga tisyu alang sa terminal oxidation (Cotter et al., 2011; Halestrap ug Wilson, 2012; Halestrap, 2012; Hugo et al., 2012). Ang mga konsentrasyon sa nagpalibot nga mga lawas sa ketone mas taas kaysa sa mga tisyu sa extrahepatic (Harrison ug Long, 1940) nga nagpakita nga ang mga lawas sa ketone gibalhin sa usa ka gradient sa konsentrasyon. Ang mga mutation sa pagkawala sa function sa MCT1 nalangkit sa kusog nga pag-atake sa ketoacidosis, nga nagsugyot sa usa ka kritikal nga papel sa pag-import sa lawas sa ketone.
� Gawas sa potensyal nga diversion sa mga lawas sa ketone ngadto sa mga non-oxidative nga kapalaran (tan-awa ang Non-oxidative metabolic fates sa mga ketone nga lawas), ang mga hepatocyte kulang sa abilidad sa pag-metabolize sa mga lawas sa ketone nga ilang gihimo. Ang mga lawas sa ketone nga gi-synthesize sa de novo pinaagi sa atay mao ang (i) catabolized sa mitochondria sa extrahepatic nga mga tisyu ngadto sa acetyl-CoA, nga anaa sa TCA cycle alang sa terminal oxidation (Fig. 1A), (ii) nga gibalhin ngadto sa lipogenesis o sterol synthesis nga mga agianan ( Fig. 1B), o (iii) gipagawas sa ihi. Isip alternatibong energetic fuel, ang mga lawas sa ketone avidly oxidized sa kasingkasing, skeletal muscle, ug utok (Balasse ug Fery, 1989; Bentourkia et al., 2009; Owen et al., 1967; Reichard et al., 1974; Sultan, 1988 ). Extrahepatic mitochondrial BDH1 catalyzes sa unang reaksyon sa ?OHB oxidation, pagkabig niini sa likod AcAc (LEHNINGER et al., 1960; Sandermann et al., 1986). Ang usa ka cytoplasmic d-?OHB-dehydrogenase (BDH2) nga adunay 20% lamang nga pagkasunod-sunod nga identidad sa BDH1 adunay taas nga Km alang sa mga lawas sa ketone, ug usab adunay papel sa iron homeostasis (Davuluri et al., 2016; Guo et al., 2006) . Sa extrahepatic mitochondrial matrix, ang AcAc gi-activate ngadto sa AcAc-CoA pinaagi sa pagbaylo sa usa ka CoA-moiety gikan sa succinyl-CoA sa usa ka reaksyon nga gi-catalyzed sa usa ka talagsaon nga mammalian CoA transferase, succinyl-CoA: 3-oxoacid-CoA transferase (SCOT, CoA transferase; gi-encode sa OXCT1), pinaagi sa usa ka duol nga equilibrium nga reaksyon. Ang libre nga enerhiya nga gipagawas sa hydrolysis sa AcAc-CoA mas dako kaysa sa succinyl-CoA, nga gipaboran ang pagporma sa AcAc. Busa ang ketone body oxidative flux mahitabo tungod sa mass action: usa ka abunda nga suplay sa AcAc ug paspas nga pagkonsumo sa acetyl-CoA pinaagi sa citrate synthase mipabor sa AcAc-CoA (+ succinate) nga pagporma sa SCOT. Ilabi na, sukwahi sa glucose (hexokinase) ug fatty acids (acyl-CoA synthetases), ang pagpaaktibo sa mga ketone nga lawas (SCOT) ngadto sa usa ka oxidizable nga porma wala magkinahanglan sa pagpamuhunan sa ATP. Ang usa ka mabalik nga reaksyon sa AcAc-CoA thiolase [na-catalyzed sa bisan unsa sa upat ka mitochondrial thiolases nga gi-encode sa ACAA2 (pag-encode sa usa ka enzyme nga nailhan nga T1 o CT), ACAT1 (encoding T2), HADHA, o HADHB] makahatag og duha ka molekula sa acetyl-CoA, nga mosulod sa TCA cycle (Hersh ug Jencks, 1967; Stern et al., 1956; Williamson et al., 1971). Atol sa mga estado sa ketotic (ie, kinatibuk-ang serum ketones> 500 �M), ang mga lawas sa ketone nahimong mahinungdanon nga mga kontribusyon sa paggasto sa enerhiya�ug gigamit sa mga tisyu nga paspas hangtud nga ang pag-uptake o saturation sa oksihenasyon mahitabo (Balasse et al., 1978; Balasse ug Fery, 1989 ; Edmond et al., 1987). Ang usa ka gamay kaayo nga bahin sa mga lawas sa ketone nga nakuha sa atay dali nga masukod sa ihi, ug ang mga rate sa paggamit ug reabsorption sa kidney parehas sa sirkulasyon nga konsentrasyon (Goldstein, 1987; Robinson ug Williamson, 1980). Atol sa kaayo ketotic estado (> 1 mM sa plasma), ketonuria nagsilbing usa ka semi-quantitative reporter sa ketosis, bisan tuod kadaghanan sa clinical assays sa ihi ketone lawas makamatikod AcAc apan dili ?OHB (Klocker et al., 2013).
Ketogenic Substrates ug ang ilang Epekto sa Hepatocyte Metabolism
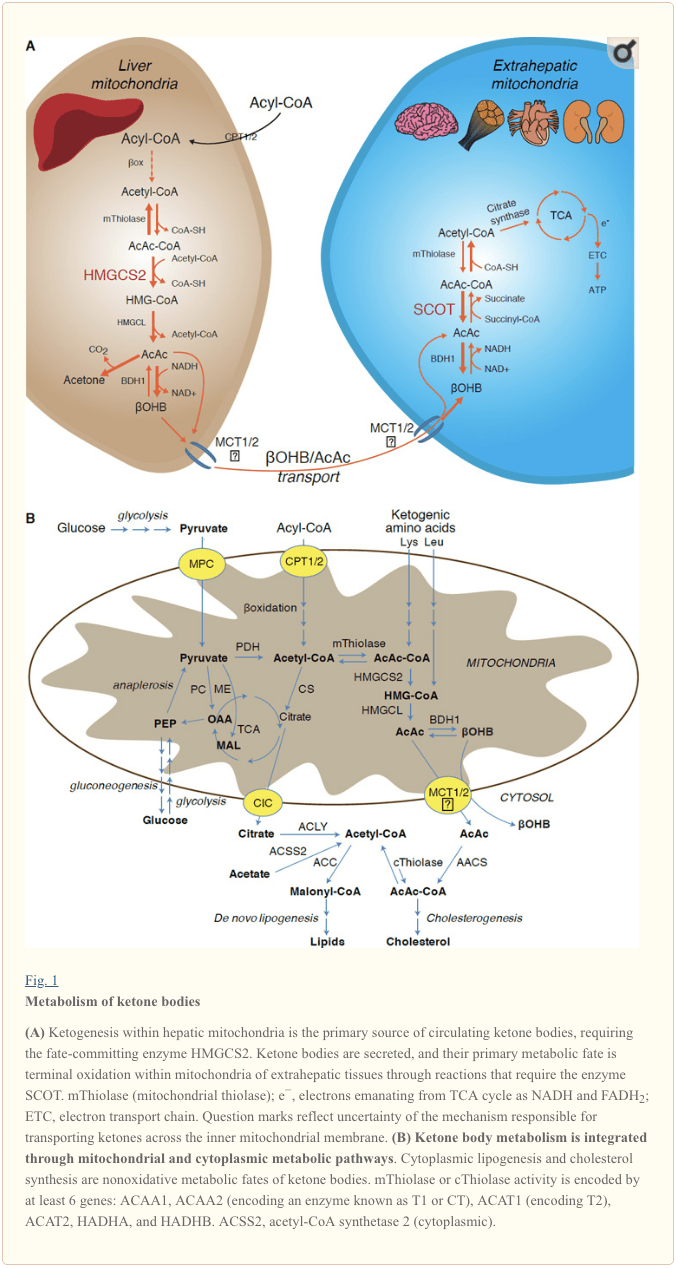
Ang ketogenic substrates naglakip sa fatty acids ug amino acids (Fig. 1B). Ang catabolism sa mga amino acid, ilabi na ang leucine, makamugna og mga 4% sa mga lawas sa ketone sa post-absorptive state (Thomas et al., 1982). Busa ang acetyl-CoA substrate pool aron makamugna og mga lawas sa ketone nag-una gikan sa mga fatty acid, tungod kay sa panahon sa pagkunhod sa suplay sa carbohydrate, ang pyruvate mosulod sa hepatic TCA cycle sa panguna pinaagi sa anaplerosis, ie, ATP-dependent carboxylation to oxaloacetate (OAA), o sa malate. (MAL), ug dili oxidative decarboxylation sa acetyl-CoA (Jeoung et al., 2012; Magnusson et al., 1991; Merritt et al., 2011). Sa atay, ang glucose ug pyruvate wala kaayo makatampo sa ketogenesis, bisan kung ang pyruvate decarboxylation sa acetyl-CoA labing kadaghan (Jeoung et al., 2012).
Ang Acetyl-CoA adunay daghang mga papel nga hinungdanon sa hepatic intermediary metabolism lapas sa ATP generation pinaagi sa terminal oxidation (tan-awa usab ang The integration of ketone body metabolism, post-translational modification, ug cell physiology). Acetyl-CoA allosterically activates (i) pyruvate carboxylase (PC), sa ingon pagpaaktibo sa usa ka metabolic control mekanismo nga nagdugang anaplerotic pagsulod sa metabolites ngadto sa TCA cycle (Owen et al., 2002; Scrutton ug Utter, 1967) ug (ii) pyruvate dehydrogenase kinase, nga nag-phosphorylates ug nagpugong sa pyruvate dehydrogenase (PDH) (Cooper et al., 1975), sa ingon dugang nga pagpauswag sa dagan sa pyruvate ngadto sa TCA cycle pinaagi sa anaplerosis. Dugang pa, ang cytoplasmic acetyl-CoA, kansang pool gidugangan sa mga mekanismo nga nagbag-o sa mitochondrial acetyl-CoA nga mga metabolite nga madala, nagpugong sa oksihenasyon sa fatty acid: ang acetyl-CoA carboxylase (ACC) nag-catalyze sa pagbag-o sa acetyl-CoA ngadto sa malonyl-CoA, ang lipogenic substrate. ug allosteric inhibitor sa mitochondrial CPT1 [gisusi sa (Kahn et al., 2005; McGarry ug Foster, 1980)]. Busa, ang mitochondrial acetyl-CoA pool parehong nag-regulate ug gi-regulate sa spillover pathway sa ketogenesis, nga nag-orchestrate sa mga importanteng aspeto sa hepatic intermediary metabolism.
Non-Oxidative Metabolic Fates sa Ketone nga mga Lawas
Ang nag-una nga kapalaran sa mga ketones nga nakuha sa atay mao ang nagsalig sa SCOT nga extrahepatic oxidation. Bisan pa, ang AcAc mahimong ma-eksport gikan sa mitochondria ug magamit sa anabolic nga mga agianan pinaagi sa pagkakabig ngadto sa AcAc-CoA pinaagi sa usa ka ATP-dependent nga reaksyon nga gi-catalyzed sa cytoplasmic acetoacetyl-CoA synthetase (AACS, Fig. 1B). Kini nga agianan aktibo sa panahon sa pagpalambo sa utok ug sa lactating mammary gland (Morris, 2005; Robinson ug Williamson, 1978; Ohgami et al., 2003). Gipahayag usab ang AACS sa adipose tissue, ug gi-activate ang mga osteoclast (Aguilo et al., 2010; Yamasaki et al., 2016). Ang Cytoplasmic AcAc-CoA mahimong idirekta pinaagi sa cytosolic HMGCS1 ngadto sa sterol biosynthesis, o gibuak sa bisan hain sa duha ka cytoplasmic thiolases ngadto sa acetyl-CoA (ACAA1 ug ACAT2), carboxylated ngadto sa malonyl-CoA, ug makatampo sa synthesis sa fatty acids (Bergstrom et. al., 1984; Edmond, 1974; Endemann et al., 1982; Geelen et al., 1983; Webber ug Edmond, 1977).
Samtang ang pisyolohikal nga kahulogan wala pa matukod, ang mga ketone mahimong magsilbing anabolic substrate bisan sa atay. Sa artipisyal nga eksperimento nga konteksto, ang AcAc makatampo sa kutob sa katunga sa bag-ong synthesized lipid, ug hangtod sa 75% sa bag-ong synthesized cholesterol (Endemann et al., 1982; Geelen et al., 1983; Freed et al., 1988). Tungod kay ang AcAc nakuha gikan sa dili kompleto nga hepatic fat oxidation, ang abilidad sa AcAc nga makatampo sa lipogenesis sa vivo magpasabot sa hepatic nga walay pulos nga pagbisikleta, diin ang mga ketones nga nakuha sa tambok mahimong magamit alang sa produksyon sa lipid, usa ka ideya kansang pisyolohikal nga kahulogan nagkinahanglan og eksperimento nga validation, apan mahimong magsilbi. mapahiangay o maladaptive nga mga tahas (Solinas et al., 2015). Ang AcAc avid nga naghatag sa cholesterogenesis, nga adunay ubos nga AACS Km-AcAc (~ 50 �M) nga mipabor sa AcAc activation bisan sa gipakaon nga estado (Bergstrom et al., 1984). Ang dinamikong papel sa cytoplasmic ketone metabolismo gisugyot sa panguna nga mouse embryonic neurons ug sa 3T3-L1 derived-adipocytes, tungod kay ang AACS knockdown nakadaot sa pagkalahi sa matag tipo sa selula (Hasegawa et al., 2012a; Hasegawa et al., 2012b). Ang pag-knockdown sa AACS sa mga ilaga sa vivo mikunhod sa serum cholesterol (Hasegawa et al., 2012c). SREBP-2, usa ka master transcriptional regulator sa cholesterol biosynthesis, ug peroxisome proliferator activated receptor (PPAR)-? mga AACS transcriptional activators, ug nag-regulate sa transcription niini sa panahon sa pagpalambo sa neurite ug sa atay (Aguilo et al., 2010; Hasegawa et al., 2012c). Sa tingub, ang cytoplasmic ketone metabolismo sa lawas mahimong importante sa pinili nga mga kondisyon o sakit natural nga mga kasaysayan, apan dili igo sa paglabay sa atay-nakuha ketone nga mga lawas, ingon nga dako nga hyperketonemia mahitabo sa setting sa pinili nga pagkadaot sa nag-unang oxidative kapalaran pinaagi sa pagkawala sa function mutations ngadto sa SCOT (Berry et al., 2001; Cotter et al., 2011).
Regulasyon sa HMGCS2 ug SCOT/OXCT1
Ang divergence sa usa ka mitochondrial gikan sa gene nga nag-encode sa cytosolic HMGCS nahitabo sayo sa vertebrate evolution tungod sa panginahanglan sa pagsuporta sa hepatic ketogenesis sa mga espisye nga adunay mas taas nga utok ngadto sa body weight ratios (Boukaftane et al., 1994; Cunnane ug Crawford, 2003). Ang natural nga pagkawala sa function nga HMGCS2 mutation sa mga tawo hinungdan sa mga pagbuto sa hypoketotic hypoglycemia (Pitt et al., 2015; Thompson et al., 1997). Ang lig-on nga ekspresyon sa HMGCS2 gilimitahan sa mga hepatocytes ug colonic epithelium, ug ang pagpahayag ug kalihokan sa enzymatic gi-coordinate pinaagi sa lainlaing mga mekanismo (Mascaro et al., 1995; McGarry ug Foster, 1980; Robinson ug Williamson, 1980). Samtang ang bug-os nga sakup sa mga estado sa pisyolohikal nga nag-impluwensya sa HMGCS2 nanginahanglan dugang nga pagpatin-aw, ang ekspresyon ug / o kalihokan niini gi-regulate sa sayo nga postnatal period, pagkatigulang, diabetes, kagutom o pag-inom sa ketogenic diet (Balasse ug Fery, 1989; Cahill GF Jr, 2006 Girard et al., 1992; Hegardt, 1999; Satapati et al., 2012; Sengupta et al., 2010). Sa fetus, ang methylation sa 5' flanking nga rehiyon sa Hmgcs2 gene inversely correlates sa transcription niini, ug partially reversed human sa pagkatawo (Arias et al., 1995; Ayte et al., 1993; Ehara et al., 2015; Ferre et al. ., 1983). Sa susama, ang hepatic Bdh1 nagpakita sa usa ka pattern sa pag-uswag sa pag-uswag, nga nagdugang gikan sa pagkahimugso hangtod sa paglutas, ug gipahinabo usab sa ketogenic nga pagkaon sa usa ka fibroblast growth factor (FGF) -21-depende nga paagi (Badman et al., 2007; Zhang et al., 1989. ). Ang ketogenesis sa mga mammal labi ka mosanong sa insulin ug glucagon, nga gipugngan ug gipukaw, matag usa (McGarry ug Foster, 1977). Gipugngan sa insulin ang lipolysis sa adipose tissue, sa ingon naghikaw sa ketogenesis sa substrate niini, samtang ang glucagon nagdugang sa ketogenic flux pinaagi sa direktang epekto sa atay (Hegardt, 1999). Ang transkripsyon sa Hmgcs2 gipukaw sa forkhead transcriptional factor nga FOXA2, nga gipugngan pinaagi sa insulin-phosphatidylinositol-3-kinase / Akt, ug giaghat sa glucagon-cAMP-p300 signaling (Arias et al., 1995; Hegardt, 1999; Quant et al. , 1990; Thumelin et al., 1993; von Meyenn et al., 2013; Wolfrum et al., 2004; Wolfrum et al., 2003). PPAR? (Rodriguez et al., 1994) kauban ang target niini, ang FGF21 (Badman et al., 2007) nag-aghat usab sa transkripsyon sa Hmgcs2 sa atay sa panahon sa kagutom o pagdumala sa ketogenic diet (Badman et al., 2007; Inagaki et al., 2007 ). Induction sa PPAR? mahimong mahitabo sa wala pa ang transisyon gikan sa fetal ngadto sa neonatal physiology, samtang ang FGF21 activation mahimong gipaboran sa sayo nga neonatal nga panahon pinaagi sa ?OHB-gipataliwala pagdili sa histone deacetylase (HDAC)-3 (Rando et al., 2016). mTORC1 (target sa mammal sa rapamycin complex 1) nagsalig sa pagpugong sa PPAR? Ang kalihokan sa transkripsyon usa usab ka hinungdanon nga regulator sa ekspresyon sa Hmgcs2 gene (Sengupta et al., 2010), ug ang atay PER2, usa ka master circadian oscillator, dili direkta nga nagkontrol sa ekspresyon sa Hmgcs2 (Chavan et al., 2016). Ang bag-o nga mga obserbasyon nagpakita nga ang extrahepatic nga tumor-induced interleukin-6 makadaut sa ketogenesis pinaagi sa PPAR? pagsumpo (Flint et al., 2016).
Ang kalihokan sa enzyme sa HMGCS2 gi-regulate pinaagi sa daghang mga PTM. Ang HMGCS2 serine phosphorylation nagpalambo sa kalihokan niini sa vitro (Grimsrud et al., 2012). Ang kalihokan sa HMGCS2 kay allosterically gipugngan sa succinyl-CoA ug lysine residue succinylation (Arias et al., 1995; Hegardt, 1999; Lowe ug Tubbs, 1985; Quant et al., 1990; Rardin et al., 2013; 1975; Thumelin et al., 1993). Ang succinylation sa HMGCS2, HMGCL, ug BDH1 lysine residues sa hepatic mitochondria mga target sa NAD + dependent deacylase sirtuin 5 (SIRT5) (Rardin et al., 2013). Ang kalihokan sa HMGCS2 gipauswag usab sa SIRT3 lysine deacetylation, ug posible nga ang crosstalk tali sa acetylation ug succinylation nag-regulate sa kalihokan sa HMGCS2 (Rardin et al., 2013; Shimazu et al., 2013). Bisan pa sa katakus niini nga mga PTM sa pag-regulate sa HMGCS2 Km ug Vmax, ang mga pag-usab-usab sa kini nga mga PTM wala pa maampingon nga mapa ug wala pa makumpirma nga mekanikal nga mga drayber sa ketogenesis sa vivo.
Ang SCOT gipahayag sa tanang mammal nga mga selula nga adunay mitochondria, gawas sa mga hepatocyte. Ang kahinungdanon sa kalihokan sa SCOT ug ketolysis gipakita sa SCOT-KO nga mga ilaga, nga nagpakita sa uniporme nga lethality tungod sa hyperketonemic hypoglycemia sulod sa 48h human sa pagkatawo (Cotter et al., 2011). Ang pagkawala sa piho nga tisyu sa SCOT sa mga neuron o skeletal myocytes nag-aghat sa mga abnormalidad sa metaboliko sa panahon sa kagutom apan dili makamatay (Cotter et al., 2013b). Sa mga tawo, ang kakulangan sa SCOT nagpakita sa sayo nga kinabuhi nga adunay grabe nga ketoacidosis, hinungdan sa pagkaluya, pagsuka, ug koma (Berry et al., 2001; Fukao et al., 2000; Kassovska-Bratinova et al., 1996; Niezen-Koning et al. , 1997; Saudubray et al., 1987; Snyderman et al., 1998; Tildon ug Cornblath, 1972). Medyo gamay ang nahibal-an sa lebel sa cellular bahin sa SCOT gene ug mga regulator sa ekspresyon sa protina. Ang ekspresyon sa Oxct1 mRNA ug ang protina ug kalihokan sa SCOT mikunhod sa mga estado sa ketotic, posible pinaagi sa mga mekanismo nga nagsalig sa PPAR (Fenselau ug Wallis, 1974; Fenselau ug Wallis, 1976; Grinblat et al., 1986; Okuda et al., 1991; Turko et al. ., 2001; Wentz et al., 2010). Sa diabetic ketoacidosis, ang mismatch tali sa hepatic ketogenesis ug extrahepatic oxidation mahimong mograbe tungod sa pagkadaot sa kalihokan sa SCOT. Ang sobrang pagpahayag sa insulin-independent glucose transporter (GLUT1 / SLC2A1) sa cardiomyocytes usab makapugong sa Oxct1 gene expression ug nagpaubos sa ketones terminal oxidation sa usa ka non-ketotic state (Yan et al., 2009). Sa atay, ang kadagaya sa Oxct1 mRNA gipugngan sa microRNA-122 ug histone methylation H3K27me3 nga makita sa panahon sa transisyon gikan sa fetal ngadto sa neonatal nga panahon (Thorrez et al., 2011). Bisan pa, ang pagsumpo sa hepatic Oxct1 nga ekspresyon sa postnatal nga panahon sa panguna tungod sa pagbakwit sa Oxct1 nga nagpahayag sa hematopoietic nga mga progenitor gikan sa atay, kaysa sa pagkawala sa kaniadto nga Oxct1 nga ekspresyon sa terminally differentiated hepatocytes. Sa tinuud, ang pagpahayag sa Oxct1 mRNA ug SCOT nga protina sa lainlain nga mga hepatocytes labi ka ubos (Orii et al., 2008).
Ang SCOT gi-regulate usab sa mga PTM. Ang enzyme kay hyper-acetylated sa utok sa SIRT3 KO nga mga ilaga, nga nagpakita usab sa pagkunhod sa AcAc dependent acetyl-CoA production (Dittenhafer-Reed et al., 2015). Ang non-enzymatic nitration sa tyrosine residues sa SCOT usab nagpahinay sa kalihokan niini, nga gitaho sa mga kasingkasing sa nagkalain-laing mga modelo sa diabetic nga mga ilaga (Marcondes et al., 2001; Turko et al., 2001; Wang et al., 2010a). Sa kasukwahi, ang tryptophan residue nitration nagdugang sa kalihokan sa SCOT (Br�g�re et al., 2010; Rebrin et al., 2007). Ang mga mekanismo sa molekula sa residue-specific nitration o de-nitration nga gidesinyo sa pag-modulate sa kalihokan sa SCOT mahimong anaa ug nagkinahanglan og elucidation.
Mga kontrobersiya sa Extrahepatic Ketogenesis
Sa mga mammal ang panguna nga ketogenic organ mao ang atay, ug ang mga hepatocytes ug gut epithelial cells ra ang nagpahayag sa mitochondrial isoform sa HMGCS2 (Cotter et al., 2013a; Cotter et al., 2014; McGarry ug Foster, 1980; Robinson ug Williamson, 1980). . Anaerobic bacterial fermentation sa complex polysaccharides yield butyrate, nga masuhop sa colonocytes sa mammalian alang sa terminal oxidation o ketogenesis (Cherbuy et al., 1995), nga mahimong adunay papel sa colonocyte differentiation (Wang et al., 2016). Gawas sa gut epithelial cells ug hepatocytes, ang HMGCS2 halos wala sa halos tanan nga ubang mammalian cells, apan ang paglaom sa extrahepatic ketogenesis gipataas sa tumor cells, astrocytes sa central nervous system, kidney, pancreatic ? mga selula, retinal pigment epithelium (RPE), ug bisan sa kaunuran sa kalabera (Adijanto et al., 2014; Avogaro et al., 1992; El Azzouny et al., 2016; Grabacka et al., 2016; Kang et al., 2015 ; Le Foll et al., 2014; Nonaka et al., 2016; Takagi et al., 2016a; Thevenet et al., 2016; Zhang et al., 2011). Ang Ectopic HMGCS2 naobserbahan sa mga tisyu nga kulang sa net ketogenic nga kapasidad (Cook et al., 2016; Wentz et al., 2010), ug HMGCS2 nagpakita sa umaabot nga ketogenesis-independent nga 'moonlighting' nga mga kalihokan, lakip ang sulod sa cell nucleus (Chen et al. , 2016; Kostiuk et al., 2010; Meertens et al., 1998).
Ang bisan unsang extrahepatic nga tisyu nga nag-oxidize sa mga lawas sa ketone adunay potensyal usab nga magtigum sa mga lawas sa ketone pinaagi sa HMGCS2 nga independente nga mga mekanismo (Fig. 2A). Bisan pa, wala’y extrahepatic nga tisyu diin ang usa ka makanunayon nga estado nga konsentrasyon sa lawas sa ketone milapas sa sirkulasyon (Cotter et al., 2011; Cotter et al., 2013b; Harrison ug Long, 1940), nga nagpasiugda nga ang mga lawas sa ketone gidala sa usa ka gradient sa konsentrasyon pinaagi sa mga mekanismo nga nagsalig sa MCT1 / 2. Ang usa ka mekanismo sa dayag nga extrahepatic ketogenesis mahimong tinuod nga nagpakita sa paryente nga pagkadaot sa ketone oxidation. Ang dugang nga potensyal nga mga pagpatin-aw nahulog sa sulud sa pagkaporma sa lawas sa ketone. Una, ang de novo ketogenesis mahimong mahitabo pinaagi sa mabalik nga enzymatic nga kalihokan sa thiolase ug SCOT (Weidemann ug Krebs, 1969). Kung ang konsentrasyon sa acetyl-CoA medyo taas, ang mga reaksyon nga kasagarang responsable sa AcAc oxidation molihok sa balik nga direksyon (GOLDMAN, 1954). Ang ikaduha nga mekanismo mahitabo sa dihang ang ?-oxidation-derived intermediate natipon tungod sa TCA cycle bottleneck, ang AcAc-CoA nakabig ngadto sa l-?OHB-CoA pinaagi sa reaksyon nga gi-catalyzed sa mitochondrial 3-hydroxyacyl-CoA dehydrogenase, ug dugang pa sa 3-hydroxybutyryl Ang CoA deacylase ngadto sa l-?OHB, nga dili mailhan pinaagi sa mass spectrometry o resonance spectroscopy gikan sa physiological enantiomer d-?OHB (Reed ug Ozand, 1980). Ang l-?OHB mahimong chromatographically o enzymatically mailhan gikan sa d-?OHB, ug anaa sa extrahepatic nga mga tisyu, apan dili sa atay o dugo (Hsu et al., 2011). Ang hepatic ketogenesis nagpatungha lamang sa d-?OHB, ang bugtong enantiomer nga usa ka substrate sa BDH (Ito et al., 1984; Lincoln et al., 1987; Reed ug Ozand, 1980; Scofield et al., 1982; Scofield et al., 1982). Ang ikatulo nga HMGCS2-independent nga mekanismo makamugna d-?OHB pinaagi sa amino acid catabolism, ilabi na sa leucine ug lysine. Ang ika-upat nga mekanismo dayag lamang tungod kay kini tungod sa usa ka artifact sa pag-label ug sa ingon gitawag nga pseudoketogenesis. Kini nga panghitabo tungod sa pagbag-o sa mga reaksyon sa SCOT ug thiolase, ug mahimong hinungdan sa sobra nga pagtan-aw sa turnover sa lawas sa ketone tungod sa isotopic dilution sa ketone body tracer sa extrahepatic tissue (Des Rosiers et al., 1990; Fink et al., 1988) . Bisan pa, ang pseudoketogenesis mahimo’g wala’y hinungdan sa kadaghanan sa mga konteksto (Bailey et al., 1990; Keller et al., 1978). Ang usa ka eskematiko (Fig. 2A) nagpakita sa usa ka mapuslanon nga pamaagi sa paggamit samtang naghunahuna sa taas nga tissue steady estado konsentrasyon sa ketones.
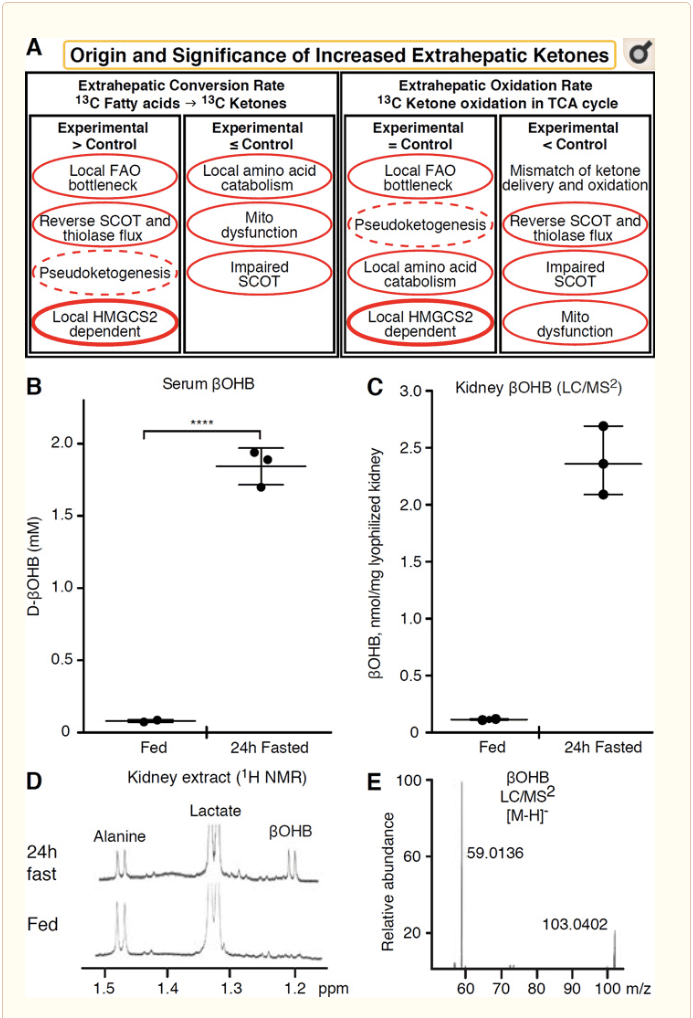

� Ang kidney bag-o lang nakadawat ug pagtagad isip posibleng ketogenic organ. Sa kadaghanan sa mga estado, ang kidney usa ka net consumer sa mga lawas sa ketone nga nakuha sa atay, nagpagawas o nag-reabsorb sa mga lawas sa ketone gikan sa agos sa dugo, ug ang kidney sa kasagaran dili usa ka net ketone body generator o concentrator (Robinson ug Williamson, 1980). Ang mga tagsulat sa usa ka klasikal nga pagtuon nakahinapos nga ang gamay nga renal ketogenesis nga gi-quantified sa usa ka artipisyal nga eksperimento nga sistema dili physiologically may kalabutan (Weidemann ug Krebs, 1969). Bag-ohay lang, ang renal ketogenesis nahibal-an sa diabetic ug autophagy deficient nga mga modelo sa mouse, apan mas lagmit nga ang multi-organ shifts sa metabolic homeostasis makausab sa integrative ketone metabolism pinaagi sa mga input sa daghang mga organo (Takagi et al., 2016a; Takagi et al., 2016b; Zhang et al., 2011). Usa ka bag-o nga publikasyon nagsugyot sa renal ketogenesis isip usa ka mekanismo sa pagpanalipod batok sa ischemia-reperfusion nga kadaot sa kidney (Tran et al., 2016). Ang hingpit nga makanunayon nga estado nga konsentrasyon sa ?OHB gikan sa mga extract sa mga ilaga sa kidney tissue gitaho sa ~4-12 mM. Aron masulayan kung kini ba mahimo ba, among gi-quantify ang ?OHB nga konsentrasyon sa mga kinuha sa bato gikan sa gipakaon ug 24h nga gipuasa nga mga ilaga. Serum ?OHB konsentrasyon misaka gikan sa ~ 100 �M ngadto sa 2 mM uban sa 24h pagpuasa (Fig. 2B), samtang bato steady estado ?OHB konsentrasyon gibana-bana nga 100 �M sa gipakaon estado, ug 1 mM lamang sa 24h pagpuasa estado (Fig. 2C�E), mga obserbasyon nga nahiuyon sa mga konsentrasyon nga gi-quantified kapin sa 45 ka tuig na ang milabay (Hems ug Brosnan, 1970). Nagpabilin nga posible nga sa mga ketotic nga estado, ang mga lawas sa ketone nga nakuha sa atay mahimong renoprotective, apan ang ebidensya alang sa renal ketogenesis nanginahanglan dugang nga ebidensya. Ang mapugsanon nga ebidensya nga nagsuporta sa tinuod nga extrahepatic ketogenesis gipresentar sa RPE (Adijanto et al., 2014). Kining makaiikag nga metabolikong pagbag-o gisugyot nga posibleng tugotan ang RPE-derived ketones nga moagos ngadto sa photoreceptor o Mller glia cells, nga makatabang sa pagbag-o sa photoreceptor sa gawas nga bahin.
?OHB isip Signaling Mediator
Bisan kung sila kusog nga dato, ang mga lawas sa ketone adunay provocative 'non-canonical' nga mga papel sa pagsenyas sa cellular homeostasis (Fig. 3) (Newman ug Verdin, 2014; Rojas-Morales et al., 2016). Pananglitan, ang ?OHB nagpugong sa Class I HDACs, nga nagdugang sa histone acetylation ug sa ingon nag-aghat sa pagpahayag sa mga gene nga nagpugong sa oxidative stress (Shimazu et al., 2013). ?OHB mismo mao ang usa ka histone covalent modifier sa lysine residues sa atay sa pagpuasa o streptozotocin induced diabetic mice (Xie et al., 2016) (tan-awa usab sa ubos, Ang integration sa ketone metabolismo sa lawas, post-translational modification, ug cell physiology, ug Mga lawas sa ketone, oxidative stress, ug neuroprotection).
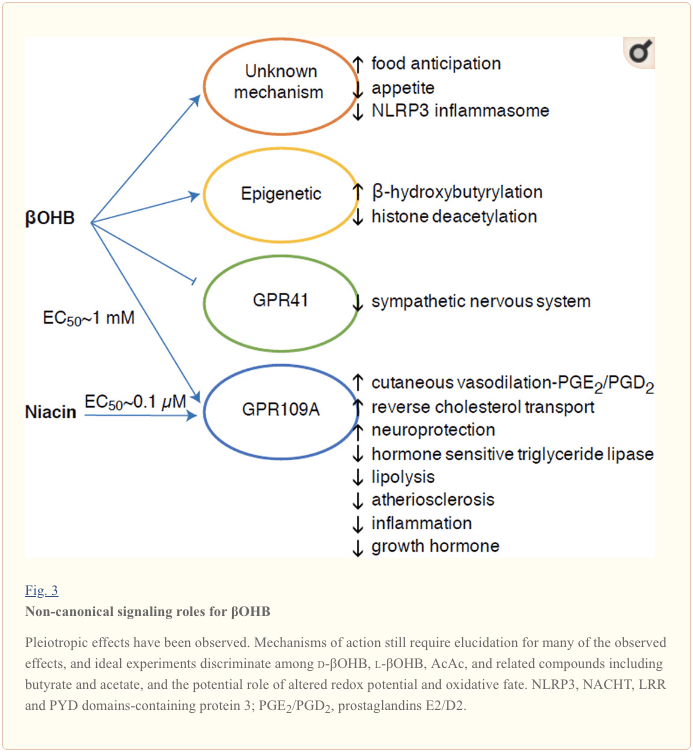
Ang OHB usa usab ka effector pinaagi sa G-protein coupled receptors. Pinaagi sa dili klaro nga mga mekanismo sa molekula, gipugngan niini ang kalihokan sa sympathetic nga sistema sa nerbiyos ug gikunhuran ang kinatibuk-ang paggasto sa enerhiya ug rate sa kasingkasing pinaagi sa pagpugong sa mubo nga kadena nga fatty acid nga pagsenyas pinaagi sa G protein inubanan sa receptor 41 (GPR41) (Kimura et al., 2011). Usa sa labing gitun-an nga mga epekto sa pagsenyas sa ?OHB nagpadayon pinaagi sa GPR109A (nailhan usab nga HCAR2), usa ka miyembro sa hydrocarboxylic acid GPCR sub-pamilya nga gipahayag sa adipose tissues (puti ug brown) (Tunaru et al., 2003), ug sa immune cells (Ahmed et al., 2009). Ang OHB mao lamang ang nailhan nga endogenous ligand sa GPR109A receptor (EC50 ~ 770 �M) nga gi-activate sa d-?OHB, l-?OHB, ug butyrate, apan dili AcAc (Taggart et al., 2005). Ang taas nga lebel sa konsentrasyon alang sa pagpaaktibo sa GPR109A nakab-ot pinaagi sa pagsunod sa usa ka ketogenic diet, kagutom, o sa panahon sa ketoacidosis, nga nagdala sa pagdili sa lipolysis sa adipose tissue. Ang anti-lipolytic nga epekto sa GPR109A nagpadayon pinaagi sa pagpugong sa adenylyl cyclase ug pagkunhod sa cAMP, pagpugong sa sensitibo nga hormone nga triglyceride lipase (Ahmed et al., 2009; Tunaru et al., 2003). Naghimo kini usa ka negatibo nga feedback loop diin ang ketosis nagbutang usa ka modulatory brake sa ketogenesis pinaagi sa pagkunhod sa pagpagawas sa mga non-esterified fatty acid gikan sa adipocytes (Ahmed et al., 2009; Taggart et al., 2005), usa ka epekto nga mahimong mabalanse sa ang simpatiya nga drive nga nagpukaw sa lipolysis. Ang Niacin (bitamina B3, nicotinic acid) usa ka lig-on (EC50 ~ 0.1 �M) ligand para sa GRP109A, epektibong gigamit sulod sa mga dekada alang sa dyslipidemias (Benyo et al., 2005; Benyo et al., 2006; Fabbrini et al., 2010a. Lukasova et al., 2011; Tunaru et al., 2003). Samtang ang niacin nagpalambo sa reverse cholesterol transport sa macrophage ug nagpamenos sa atherosclerotic lesions (Lukasova et al., 2011), ang mga epekto sa ?OHB sa atherosclerotic lesions nagpabilin nga wala mahibal-an. Bisan tuod ang GPR109A receptor adunay mga papel sa pagpanalipod, ug ang makaiikag nga mga koneksyon anaa tali sa ketogenic diet nga paggamit sa stroke ug neurodegenerative nga mga sakit (Fu et al., 2015; Rahman et al., 2014), usa ka protective nga papel sa ?OHB pinaagi sa GPR109A wala gipakita sa vivo .
Sa katapusan, ang ?OHB mahimong makaimpluwensya sa gana ug pagkabusog. Ang usa ka meta-analysis sa mga pagtuon nga nagsukod sa mga epekto sa ketogenic ug ubos kaayo nga mga diyeta sa enerhiya nakahinapos nga ang mga partisipante nga nag-usik niini nga mga diyeta nagpakita sa mas taas nga pagkabusog, kon itandi sa pagkontrol sa mga diyeta (Gibson et al., 2015). Bisan pa, ang usa ka katuohan nga katin-awan alang sa kini nga epekto mao ang dugang nga metaboliko o hormonal nga mga elemento nga mahimo’g magbag-o sa gana. Pananglitan, ang mga ilaga nga gipadayon sa usa ka rodent ketogenic nga pagkaon nagpakita sa dugang nga paggasto sa enerhiya kumpara sa chow control-fed nga mga ilaga, bisan pa sa susama nga caloric intake, ug ang circulating leptin o mga gene sa peptides nga nag-regulate sa feeding behavior wala mausab (Kennedy et al., 2007). Lakip sa gisugyot nga mga mekanismo nga nagsugyot sa pagpugong sa gana sa ?OHB naglakip sa signal ug oksihenasyon (Laeger et al., 2010). Ang espesipikong pagtangtang sa hepatocyte sa circadian rhythm gene (Per2) �ug chromatin immunoprecipitation nga mga pagtuon nagpadayag nga ang PER2 direkta nga nagpalihok sa Cpt1a gene, ug dili direkta nga nag-regulate sa Hmgcs2, nga nagdala sa pagkadaot sa ketosis sa Per2 knockout nga mga ilaga (Chavan et al., 2016). Kini nga mga ilaga nagpakita sa dili maayo nga pagpaabut sa pagkaon, nga partially gipahiuli pinaagi sa systemic ?OHB nga administrasyon. Ang umaabot nga mga pagtuon gikinahanglan aron makumpirma ang sentral nga sistema sa nerbiyos ingon usa ka direkta nga target sa ?OHB, ug kung gikinahanglan ang oksihenasyon sa ketone alang sa naobserbahan nga mga epekto, o kung adunay laing mekanismo sa pagsenyas nga nalangkit. Ang uban nga mga imbestigador naghangyo sa posibilidad sa lokal nga astrocyte-derived ketogenesis sulod sa ventromedial hypothalamus isip regulator sa pag-inom sa pagkaon, apan kini nga mga pasiuna nga obserbasyon makabenepisyo usab gikan sa genetic ug flux-based assessments (Le Foll et al., 2014). Ang relasyon tali sa ketosis ug kakulang sa sustansya nagpabilin nga interes tungod kay ang kagutom ug pagkabusog importante nga mga elemento sa napakyas nga mga pagsulay sa pagkawala sa timbang.
Paghiusa sa Ketone Body Metabolism, Post-Translational Modification, ug Cell Physiology
Ang mga lawas sa ketone nakatampo sa mga compartmentalized pool sa acetyl-CoA, usa ka yawe nga intermediate nga nagpakita sa mga prominenteng papel sa cellular metabolism (Pietrocola et al., 2015). Usa ka tahas sa acetyl-CoA mao ang pagsilbi nga substrate alang sa acetylation, usa ka enzymatically-catalyzed histone covalent modification (Choudhary et al., 2014; Dutta et al., 2016; Fan et al., 2015; Menzies et al., 2016. ). Daghang gidaghanon sa mga dynamically acetylated mitochondrial proteins, nga kadaghanan niini mahimong mahitabo pinaagi sa non-enzymatic nga mga mekanismo, mitumaw usab gikan sa computational proteomics nga mga pagtuon (Dittenhafer-Reed et al., 2015; Hebert et al., 2013; Rardin et al., 2013. ; Shimazu et al., 2010). Ang lysine deacetylases naggamit ug zinc cofactor (eg, nucleocytosolic HDACs) o NAD+ isip co-substrate (sirtuins, SIRTs) (Choudhary et al., 2014; Menzies et al., 2016). Ang acetylproteome nagsilbing sensor ug effector sa kinatibuk-ang cellular acetyl-CoA pool, tungod kay ang physiological ug genetic manipulations matag usa moresulta sa non-enzymatic global variations sa acetylation (Weinert et al., 2014). Ingon nga ang mga intracellular metabolites nagsilbi nga modulators sa lysine residue acetylation, importante nga tagdon ang papel sa mga lawas sa ketone, kansang kadagaya hilabihan ka dinamiko.
Ang OHB usa ka epigenetic modifier pinaagi sa labing menos duha ka mekanismo. Ang pagtaas sa lebel sa ?OHB nga gipahinabo sa pagpuasa, pagdili sa kaloriya, direkta nga pagdumala o dugay nga ehersisyo naghagit sa pagdili sa HDAC o pagpaaktibo sa histone acetyltransferase (Marosi et al., 2016; Sleiman et al., 2016) o sa oxidative stress (Shimazu et al., 2013) . Ang pagdili sa OHB sa HDAC3 mahimong mag-regulate sa bag-ong natawo nga metabolic physiology (Rando et al., 2016). Independently, ?OHB sa iyang kaugalingon direkta modifies histone lysine residues (Xie et al., 2016). Ang dugay nga pagpuasa, o steptozotocin-induced diabetic ketoacidosis nagdugang histone ?-hydroxybutyrylation. Bisan tuod ang gidaghanon sa lysine ?-hydroxybutyrylation ug acetylation sites kay ikatandi, ang stoichiometrically mas dako nga histone ?-hydroxybutyrylation kay sa acetylation naobserbahan. Ang lahi nga mga gene naapektuhan sa histone lysine ?-hydroxybutyrylation, batok sa acetylation o methylation, nga nagsugyot og lahi nga mga cellular function. Kung ang ?-hydroxybutyrylation kay spontaneous o enzymatic wala mahibal-an, apan nagpalapad sa lain-laing mga mekanismo pinaagi sa mga lawas sa ketone nga dinamikong nakaimpluwensya sa transkripsyon.
Ang importante nga cell reprogramming nga mga panghitabo sa panahon sa caloric restriction ug nutrient deprivation mahimong gipataliwad-an sa SIRT3- ug SIRT5-dependent mitochondrial deacetylation ug desuccinylation, matag usa, nga nag-regulate sa ketogenic ug ketolytic nga mga protina sa post-translational nga lebel sa atay ug extrahepatic nga mga tisyu (Dittenhafer-Reed et al. 2015; Hebert et al., 2013; Rardin et al., 2013; Shimazu et al., 2010). Bisan kung ang stoichiometric nga pagtandi sa gi-okupar nga mga site dili kinahanglan nga direktang mag-link sa mga pagbag-o sa metabolic flux, ang mitochondrial acetylation dinamiko ug mahimo nga gimaneho sa konsentrasyon sa acetyl-CoA o mitochondrial pH, kaysa enzymatic acetyltransferases (Wagner ug Payne, 2013). Nga ang SIRT3 ug SIRT5 modulate sa mga kalihokan sa ketone body metabolizing enzymes naghagit sa pangutana sa reciprocal nga papel sa mga ketones sa pag-sculpting sa acetylproteome, succinylproteome, ug uban pang dinamikong cellular target. Sa tinuud, ingon nga ang mga pagbag-o sa ketogenesis nagpakita sa mga konsentrasyon sa NAD +, ang produksiyon ug kadagaya sa ketone mahimong makontrol ang kalihokan sa sirtuin, sa ingon makaimpluwensya sa kinatibuk-ang acetyl-CoA / succinyl-CoA pool, ang acylproteome, ug sa ingon mitochondrial ug cell physiology. ?-hydroxybutyrylation sa enzyme lysine residues mahimong makadugang sa laing layer sa cellular reprogramming. Sa extrahepatic nga mga tisyu, ang oksihenasyon sa lawas sa ketone mahimong makapukaw sa susama nga mga pagbag-o sa homeostasis sa selula. Samtang ang compartmentation sa acetyl-CoA pools kaayo nga gi-regulate ug nag-coordinate sa usa ka halapad nga spectrum sa mga pagbag-o sa cellular, ang abilidad sa mga ketone nga lawas sa direktang paghulma sa duha nga mitochondrial ug cytoplasmic acetyl-CoA nga mga konsentrasyon nagkinahanglan og elucidation (Chen et al., 2012; Corbet et al., 2016; Pougovkina et al., 2014; Schwer et al., 2009; Wellen ug Thompson, 2012). Tungod kay ang mga konsentrasyon sa acetyl-CoA hugot nga gi-regulate, ug ang acetyl-CoA dili impermeant sa lamad, hinungdanon nga tagdon ang mga mekanismo sa drayber nga nag-coordinate sa acetyl-CoA homeostasis, lakip ang mga rate sa produksiyon ug terminal nga oksihenasyon sa siklo sa TCA, pagkakabig sa mga lawas sa ketone, mitochondrial. efflux pinaagi sa carnitine acetyltransferase (CrAT), o acetyl-CoA export ngadto sa cytosol human sa pagkakabig ngadto sa citrate ug pagpagawas sa ATP citrate lyase (ACLY). Ang mahinungdanong tahas niining ulahing mga mekanismo sa cell acetylproteome ug homeostasis nanginahanglan ug katugbang nga pagsabot sa mga tahas sa ketogenesis ug ketone oxidation (Das et al., 2015; McDonnell et al., 2016; Moussaieff et al., 2015; Overmyer et al., 2015; Seiler et al., 2014; Seiler et al., 2015; Wellen et al., 2009; Wellen ug Thompson, 2012). Ang mga convergent nga teknolohiya sa metabolomics ug acylproteomics sa setting sa genetically manipulated nga mga modelo gikinahanglan aron matino ang mga target ug resulta.
Anti- ug Pro-Inflammatory nga mga Tubag sa mga Lawas nga Ketone
Ang mga lawas sa ketosis ug ketone nag-modulate sa paghubag ug pag-obra sa immune cell, apan gisugyot ang lainlain ug bisan ang dili managsama nga mga mekanismo. Ang dugay nga kakulang sa sustansya makapamenos sa panghubag (Youm et al., 2015), apan ang chronic ketosis sa type 1 nga diabetes usa ka pro-inflammatory state (Jain et al., 2002; Kanikarla-Marie ug Jain, 2015; Kurepa et al., 2012. ). Ang mga papel sa pagsenyas nga gibase sa mekanismo alang sa ?OHB sa panghubag mitumaw tungod kay daghang mga selula sa immune system, lakip ang mga macrophage o monocytes, abunda nga nagpahayag sa GPR109A. Samtang ang ?OHB adunay usa ka kasagaran nga anti-inflammatory nga tubag (Fu et al., 2014; Gambhir et al., 2012; Rahman et al., 2014; Youm et al., 2015), taas nga konsentrasyon sa mga lawas sa ketone, ilabi na ang AcAc, mahimong hinungdan sa usa ka pro-inflammatory nga tubag (Jain et al., 2002; Kanikarla-Marie ug Jain, 2015; Kurepa et al., 2012).
Ang mga anti-inflammatory nga papel sa GPR109A ligand sa atherosclerosis, sobra nga katambok, sakit sa panghubag sa bituka, sakit sa neurological, ug kanser gisusi (Graff et al., 2016). Ang ekspresyon sa GPR109A gipadako sa mga selula sa RPE sa mga modelo sa diabetes, mga pasyente sa diabetes sa tawo (Gambhir et al., 2012), ug sa microglia sa panahon sa neurodegeneration (Fu et al., 2014). Ang mga epekto sa anti-inflammatory sa ?OHB gipalambo sa GPR109A nga sobra nga pagpahayag sa mga selula sa RPE, ug giwagtang sa pharmacological inhibition o genetic knockout sa GPR109A (Gambhir et al., 2012). ?OHB ug exogenous nicotinic acid (Taggart et al., 2005), parehong naghatag og anti-inflammatory effect sa TNF? o LPS-induced inflammation pinaagi sa pagkunhod sa lebel sa pro-inflammatory proteins (iNOS, COX-2), o secreted cytokines (TNF?, IL-1?, IL-6, CCL2/MCP-1), sa bahin pinaagi sa pagpugong sa NF -?B translokasyon (Fu et al., 2014; Gambhir et al., 2012). ?OHB mikunhod ER stress ug ang NLRP3 inflammasome, pagpaaktibo sa antioxidative stress tubag (Bae et al., 2016; Youm et al., 2015). Bisan pa, sa neurodegenerative nga panghubag, ang GPR109A-dependent ?OHB-mediated nga proteksyon wala maglakip sa makapahubag nga mga tigpataliwala sama sa MAPK pathway signaling (pananglitan, ERK, JNK, p38) (Fu et al., 2014), apan mahimong magkinahanglan sa COX-1 nga nagsalig sa PGD2 produksyon (Rahman et al., 2014). Makapaikag nga ang macrophage GPR109A gikinahanglan nga adunay neuroprotective effect sa usa ka ischemic stroke model (Rahman et al., 2014), apan ang abilidad sa ?OHB sa pagpugong sa NLRP3 inflammasome sa bone marrow nga nakuha nga macrophage mao ang GPR109A independente (Youm et al. ., 2015). Bisan tuod ang kadaghanan sa mga pagtuon nagsumpay sa ?OHB sa anti-inflammatory effects, ?OHB mahimong pro-inflammatory ug makadugang sa mga marker sa lipid peroxidation sa calf hepatocytes (Shi et al., 2014). Ang anti- versus pro-inflammatory nga mga epekto sa ?OHB mahimong magdepende sa tipo sa selula, ?konsentrasyon sa OHB, gidugayon sa pagkaladlad, ug ang presensya o pagkawala sa mga co-modulators.
Dili sama sa ?OHB, ang AcAc mahimong magpalihok sa pro-inflammatory signaling. Ang taas nga AcAc, labi na sa taas nga konsentrasyon sa glucose, nagpakusog sa kadaot sa endothelial cell pinaagi sa usa ka mekanismo nga nagsalig sa NADPH oxidase / oxidative stress (Kanikarla-Marie ug Jain, 2015). Ang taas nga konsentrasyon sa AcAc sa umbilical cord sa mga inahan nga adunay diabetes adunay kalabotan sa mas taas nga rate sa oksihenasyon sa protina ug konsentrasyon sa MCP-1 (Kurepa et al., 2012). Ang taas nga AcAc sa mga pasyente nga adunay diabetes adunay kalabotan sa TNF? ekspresyon (Jain et al., 2002), ug AcAc, apan dili ?OHB, induced TNF?, MCP-1 expression, ROS accumulation, ug pagkunhod sa cAMP level sa U937 human monocyte cells (Jain et al., 2002; Kurepa et al. ., 2012).
Ang ketone body dependent signaling phenomena kanunay nga ma-trigger lamang sa taas nga ketone body concentrations (> 5 mM), ug sa kaso sa daghang mga pagtuon nga nag-link sa mga ketone ngadto sa pro- o anti-inflammatory nga mga epekto, pinaagi sa dili klaro nga mga mekanismo. Dugang pa, tungod sa nagkasumpaki nga mga epekto sa ?OHB versus AcAc sa panghubag, ug ang abilidad sa AcAc/?OHB ratio sa pag-impluwensya sa mitochondrial redox nga potensyal, ang labing maayo nga mga eksperimento nga nag-assess sa mga papel sa ketone nga mga lawas sa cellular phenotypes itandi ang mga epekto sa AcAc ug ? OHB sa lain-laing mga ratios, ug sa lain-laing mga cumulative konsentrasyon [eg, (Saito et al., 2016)]. Sa kataposan, ang AcAc mahimong mapalit sa komersyo lamang ingong lithium salt o ingong ethyl ester nga nagkinahanglan ug base hydrolysis sa dili pa gamiton. Ang Lithium cation independente nga nag-aghat sa mga signal transduction cascades (Manji et al., 1995), ug ang AcAc anion labile. Sa katapusan, ang mga pagtuon gamit ang racemic d/l-?OHB mahimong malibog, tungod kay ang d-?OHB stereoisomer lang ang mahimong oxidized sa AcAc, apan d-?OHB ug l-?OHB ang matag signal pinaagi sa GPR109A, makapugong sa NLRP3 inflammasome, ug nagsilbing lipogenic substrates.
Mga Lawas sa Ketone, Oxidative Stress, ug Neuroprotection
Ang oxidative stress kasagaran gihubit ingon usa ka estado diin ang ROS gipresentar nga sobra, tungod sa sobra nga produksiyon ug / o pagkadaot sa pagtangtang. Ang antioxidant ug oxidative stress mitigating nga mga papel sa mga lawas sa ketone kaylap nga gihulagway sa in vitro ug in vivo, ilabi na sa konteksto sa neuroprotection. Tungod kay ang kadaghanan sa mga neuron dili epektibo nga makamugna og high-energy phosphates gikan sa fatty acids—apan nag-oxidize sa mga lawas sa ketone kung kulang ang mga carbohydrates, ang mga neuroprotective nga epekto sa mga lawas sa ketone labi ka hinungdanon (Cahill GF Jr, 2006; Edmond et al., 1987; Yang ug uban pa, 1987). Sa oxidative stress models, ang BDH1 induction ug SCOT suppression nagsugyot nga ang metabolismo sa ketone nga lawas mahimong i-reprogram aron mapadayon ang lainlain nga signal sa cell, potensyal nga redox, o mga kinahanglanon sa metaboliko (Nagao et al., 2016; Tieu et al., 2003).
Ang mga lawas sa ketone nagpamenos sa mga grado sa kadaot sa selula, kadaot, kamatayon ug ubos nga apoptosis sa mga neuron ug cardiomyocytes (Haces et al., 2008; Maalouf et al., 2007; Nagao et al., 2016; Tieu et al., 2003). Ang gisangpit nga mga mekanismo managlahi ug dili kanunay nga linear nga may kalabutan sa konsentrasyon. Ubos nga millimolar nga konsentrasyon sa (d o l)-?OHB scavenge ROS (hydroxyl anion), samtang ang AcAc nag-scavenges sa daghang mga ROS species, apan sa mga konsentrasyon lamang nga molapas sa physiological range (IC50 20-67 mM) (Haces et al., 2008) . Sa kasukwahi, ang usa ka mapuslanon nga impluwensya sa redox nga potensyal sa transport chain sa elektron usa ka mekanismo nga sagad nga nalambigit sa d-?OHB. Samtang ang tanan nga tulo ka mga lawas sa ketone (d / l-?OHB ug AcAc) nakunhuran ang pagkamatay sa neuronal cell ug ang pagtipon sa ROS nga gipahinabo sa pagdili sa kemikal sa glycolysis, ang d-?OHB ug AcAc lamang ang nakapugong sa pagkunhod sa neuronal ATP. Sa kasukwahi, sa usa ka hypoglycemic sa vivo nga modelo, (d o l) -?OHB, apan dili AcAc makapugong sa hippocampal lipid peroxidation (Haces et al., 2008; Maalouf et al., 2007; Marosi et al., 2016; Murphy, 2009 Tieu et al., 2003). Sa vivo nga mga pagtuon sa mga ilaga nga gipakaon sa ketogenic diet (87% kcal fat ug 13% nga protina) nagpakita sa neuroanatomical variation sa antioxidant capacity (Ziegler et al., 2003), diin ang labing lawom nga mga kausaban naobserbahan sa hippocampus, nga adunay pagtaas sa glutathione peroxidase ug total antioxidant nga kapasidad.
Ketogenic diet, ketone esters (tan-awa usab ang Therapeutic nga paggamit sa ketogenic diet ug exogenous ketone nga mga lawas), o ?OHB nga administrasyon naggamit sa neuroprotection sa mga modelo sa ischemic stroke (Rahman et al., 2014); Parkinson's disease (Tieu et al., 2003); central nervous system oxygen toxicity seizure (D'Agostino et al., 2013); epileptic spasms (Yum et al., 2015); mitochondrial encephalomyopathy, lactic acidosis ug stroke-like (MELAS) episodes syndrome (Frey et al., 2016) ug Alzheimer's disease (Cunnane ug Crawford, 2003; Yin et al., 2016). Sa kasukwahi, ang usa ka bag-o nga taho nagpakita sa histopathological nga ebidensya sa neurodegenerative nga pag-uswag pinaagi sa usa ka ketogenic diet sa usa ka transgenic mouse nga modelo sa abnormal nga mitochondrial DNA repair, bisan pa sa pagtaas sa mitochondrial biogenesis ug antioxidant signatures (Lauritzen et al., 2016). Ang ubang nagkasumpaki nga mga taho nagsugyot nga ang pagkaladlad sa taas nga konsentrasyon sa lawas sa ketone nagpahinabog oxidative stress. Ang taas nga ?OHB o AcAc nga dosis nag-aghat sa pagtago sa nitric oxide, lipid peroxidation, pagkunhod sa pagpahayag sa SOD, glutathione peroxidase ug catalase sa calf hepatocytes, samtang sa hepatocytes sa ilaga ang MAPK pathway induction gipasangil sa AcAc apan dili ?OHB (Abdelmegeed et al., 2004. ; Shi et al., 2014; Shi et al., 2016).
Gihiusa, kadaghanan sa mga taho nag-link sa ?OHB ngadto sa attenuation sa oxidative stress, tungod kay ang administrasyon niini nagpugong sa produksiyon sa ROS/superoxide, nagpugong sa lipid peroxidation ug protina nga oksihenasyon, nagdugang sa lebel sa antioxidant nga protina, ug nagpalambo sa mitochondrial respiration ug ATP production (Abdelmegeed et al., 2004; Haces et al., 2008; Jain et al., 1998; Jain et al., 2002; Kanikarla-Marie ug Jain, 2015; Maalouf et al., 2007; Maalouf ug Rho, 2008; Marosi et al., 2016; Tieu et al., 2003; Yin et al., 2016; Ziegler et al., 2003). Samtang ang AcAc mas direkta nga nakig-alayon kay sa ?OHB nga adunay induction sa oxidative stress, kini nga mga epekto dili kanunay dali nga maputol gikan sa umaabot nga pro-inflammatory nga mga tubag (Jain et al., 2002; Kanikarla-Marie ug Jain, 2015; Kanikarla-Marie ug Jain, 2016). Dugang pa, importante nga hunahunaon nga ang dayag nga antioxidative nga benepisyo nga gihatag sa pleiotropic ketogenic diets mahimong dili mabalhin sa mga ketone nga lawas mismo, ug ang neuroprotection nga gihatag sa ketone nga mga lawas mahimong dili hingpit nga tungod sa oxidative stress. Pananglitan sa panahon sa glucose deprivation, sa usa ka modelo sa glucose deprivation sa cortical neurons, ?OHB stimulated autophagic flux ug gipugngan ang autophagosome accumulation, nga nalangkit sa pagkunhod sa neuronal kamatayon (Camberos-Luna et al., 2016). d-?OHB induces usab ang canonical antioxidant protina FOXO3a, SOD, MnSOD, ug catalase, prospectively pinaagi sa HDAC pagdili (Nagao et al., 2016; Shimazu et al., 2013).
Non-Alcoholic Fatty Liver Disease (NAFLD) ug Ketone Body Metabolism
Ang NAFLD nga may kalabotan sa hilabihang katambok ug ang dili alkoholikong steatohepatitis (NASH) mao ang kasagarang mga hinungdan sa sakit sa atay sa mga nasod sa Kasadpan (Rinella ug Sanyal, 2016), ug ang pagkapakyas sa atay nga gipahinabo sa NASH mao ang usa sa kasagarang mga hinungdan sa pagbalhin sa atay. Samtang ang sobra nga pagtipig sa triacylglycerols sa mga hepatocytes> 5% sa gibug-aton sa atay (NAFL) lamang dili hinungdan sa degenerative function sa atay, ang pag-uswag sa NAFLD sa mga tawo adunay kalabotan sa systemic nga resistensya sa insulin ug dugang nga peligro sa type 2 diabetes, ug mahimong makatampo sa pathogenesis sa cardiovascular disease ug chronic kidney disease (Fabbrini et al., 2009; Targher et al., 2010; Targher ug Byrne, 2013). Ang mga pathogenic nga mekanismo sa NAFLD ug NASH dili kompleto nga masabtan apan naglakip sa mga abnormalidad sa metabolismo sa hepatocyte, hepatocyte autophagy ug endoplasmic reticulum stress, hepatic immune cell function, adipose tissue inflammation, ug systemic inflammatory mediators (Fabbrini et al., 2009; Masuoka ug Chalasani, 2013). Targher et al., 2010; Yang et al., 2010). Ang mga pagbag-o sa metabolismo sa carbohydrate, lipid, ug amino acid mahitabo ug makatampo sa hilabihang katambok, diabetes, ug NAFLD sa mga tawo ug sa modelo nga mga organismo [gisusi sa (Farese et al., 2012; Lin ug Accili, 2011; Newgard, 2012; Samuel ug Shulman, 2012; Sun ug Lazar, 2013). Samtang ang mga abnormalidad sa hepatocyte sa cytoplasmic lipid metabolismo kasagarang naobserbahan sa NAFLD (Fabbrini et al., 2010b), ang papel sa mitochondrial metabolism, nga nagdumala sa oxidative disposal sa mga tambok dili kaayo klaro sa NAFLD pathogenesis. Ang mga abnormalidad sa metabolismo sa mitochondrial mahitabo ug makatampo sa NAFLD / NASH pathogenesis (Hyotylainen et al., 2016; Serviddio et al., 2011; Serviddio et al., 2008; Wei et al., 2008). Adunay kinatibuk-an (Felig et al., 1974; Iozzo et al., 2010; Koliaki et al., 2015; Satapati et al., 2015; Satapati et al., 2012; Sunny et al., 2011) apan dili uniporme ( Koliaki ug Roden, 2013; Perry et al., 2016; Rector et al., 2010) consensus nga, sa wala pa ang pagpalambo sa bona fide NASH, hepatic mitochondrial oxidation, ug sa partikular nga fat oxidation, gipadako sa hilabihang katambok, systemic insulin resistance , ug NAFLD. Lagmit nga samtang nag-uswag ang NAFLD, ang oxidative capacity heterogenity, bisan sa tagsa-tagsa nga mitochondria, mitungha, ug sa katapusan ang oxidative function mahimong madaot (Koliaki et al., 2015; Rector et al., 2010; Satapati et al., 2008; Satapati et al. ., 2012).
Ang ketogenesis kanunay nga gigamit ingon usa ka proxy alang sa hepatic fat oxidation. Ang mga pagkadaot sa ketogenesis mitungha samtang ang NAFLD nag-uswag sa mga modelo sa hayop, ug lagmit sa mga tawo. Pinaagi sa dili kompleto nga gihubit nga mga mekanismo, ang hyperinsulinemia nagpugong sa ketogenesis, nga posibleng makatampo sa hypoketonemia kon itandi sa lean controls (Bergman et al., 2007; Bickerton et al., 2008; Satapati et al., 2012; Soeters et al., 2009; Sunny et al. , 2011; Vice et al., 2005). Bisan pa, ang abilidad sa pagpalibot sa mga konsentrasyon sa lawas sa ketone aron matagna ang NAFLD kontrobersyal (Mnnist et al., 2015; Sanyal et al., 2001). Ang lig-on nga quantitative magnetic resonance spectroscopic nga mga pamaagi sa mga modelo sa hayop nagpadayag sa pagtaas sa ketone turnover rate nga adunay kasarangan nga resistensya sa insulin, apan ang pagkunhod sa mga rate makita sa mas grabe nga resistensya sa insulin (Satapati et al., 2012; Sunny et al., 2010). Sa tambok nga mga tawo nga adunay tambok nga atay, ang ketogenic rate kay normal (Bickerton et al., 2008; Sunny et al., 2011), ug busa, ang mga rate sa ketogenesis mikunhod kalabot sa dugang nga fatty acid load sulod sa mga hepatocytes. Tungod niini, ang ?-oxidation-derived acetyl-CoA mahimong idirekta sa terminal oxidation sa TCA cycle, pagdugang sa terminal oxidation, phosphoenolpyruvate-driven gluconeogenesis pinaagi sa anaplerosis/cataplerosis, ug oxidative stress. Ang Acetyl-CoA mahimo usab nga moagi sa eksport gikan sa mitochondria isip citrate, usa ka precursor substrate alang sa lipogenesis (Fig. 4) (Satapati et al., 2015; Satapati et al., 2012; Solinas et al., 2015). Samtang ang ketogenesis mahimong dili kaayo responsive sa insulin o pagpuasa nga adunay dugay nga katambok (Satapati et al., 2012), ang nagpahiping mga mekanismo ug ang mga sangputanan sa ubos niini nagpabilin nga dili kompleto nga nasabtan. Ang bag-o nga ebidensya nagpakita nga ang mTORC1 nagpugong sa ketogenesis sa paagi nga mahimong ubos sa agos sa insulin signaling (Kucejova et al., 2016), nga nahiuyon sa mga obserbasyon nga ang mTORC1 nagpugong sa PPAR?-mediated Hmgcs2 induction (Sengupta et al., 2010) ( tan-awa usab ang Regulasyon sa HMGCS2 ug SCOT/OXCT1).

Ang pasiuna nga mga obserbasyon gikan sa among grupo nagsugyot sa dili maayo nga mga sangputanan sa hepatic sa kakulang sa ketogenic (Cotter et al., 2014). Aron sulayan ang pangagpas nga nakadaot sa ketogenesis, bisan sa carbohydrate-replete ug sa ingon �non-ketogenic� nga mga estado, nakatampo sa abnormal nga metabolismo sa glucose ug naghagit sa steatohepatitis, nakamugna kami og modelo sa mouse sa gimarkahan nga ketogenic insufficiency pinaagi sa pagdumala sa antisense oligonucleotides (ASO) nga gitumong sa Hmgcs2. Ang pagkawala sa HMGCS2 sa standard nga low-fat chow-fed adult nga mga ilaga hinungdan sa malumo nga hyperglycemia ug dako nga pagtaas sa produksiyon sa gatusan ka hepatic metabolites, usa ka suite nga kusganong nagsugyot sa pagpaaktibo sa lipogenesis. Ang pagpakaon sa taas nga tambok nga pagkaon sa mga ilaga nga adunay dili igo nga ketogenesis miresulta sa daghang kadaot sa hepatocyte ug panghubag. Kini nga mga nahibal-an nagsuporta sa sentral nga mga pangagpas nga (i) ang ketogenesis dili usa ka passive overflow nga agianan kondili usa ka dinamikong node sa hepatic ug integrated physiological homeostasis, ug (ii) maalamon nga ketogenic augmentation aron mapagaan ang NAFLD / NASH ug ang disordered hepatic glucose metabolismo takus sa eksplorasyon .
Sa unsang paagi ang pagkadaot sa ketogenesis makatampo sa kadaot sa atay ug giusab ang homeostasis sa glucose? Ang una nga konsiderasyon mao kung ang hinungdan mao ang kakulangan sa ketogenic flux, o mga ketone mismo. Ang usa ka bag-o nga taho nagsugyot nga ang mga lawas sa ketone mahimo’g makunhuran ang kadaot sa hepatic nga gipahinabo sa stress sa oxidative agig tubag sa n-3 polyunsaturated fatty acid (Pawlak et al., 2015). Hinumdomi nga tungod sa kakulang sa pagpahayag sa SCOT sa mga hepatocytes, ang mga lawas sa ketone dili ma-oxidized, apan makatampo sila sa lipogenesis, ug mag-alagad sa lainlaing mga papel sa pagsenyas nga independente sa ilang oksihenasyon (tan-awa usab ang Non-oxidative metabolic fates sa mga ketone nga lawas ug ?OHB isip usa ka tigpataliwala sa senyales). Posible usab nga ang mga lawas sa ketone nga nakuha sa hepatocyte mahimong magsilbi nga signal ug / o metabolite alang sa mga silingan nga tipo sa selula sulod sa hepatic acinus, lakip ang mga stellate cells ug Kupffer cell macrophage. Samtang ang limitado nga literatura nga magamit nagsugyot nga ang mga macrophage dili makahimo sa pag-oxidize sa mga lawas sa ketone, kini gisukod lamang gamit ang klasikal nga mga pamaagi, ug sa peritoneal macrophage lamang (Newsholme et al., 1986; Newsholme et al., 1987), nga nagpakita nga ang usa ka re- Ang pagtasa angayan nga gihatag sa daghang ekspresyon sa SCOT sa mga macrophage nga nakuha sa utok sa bukog (Youm et al., 2015).
Ang hepatocyte ketogenic flux mahimo usab nga cytoprotective. Samtang ang mga mekanismo sa salutary dili magdepende sa ketogenesis per se, ang ubos nga carbohydrate ketogenic diets nalangkit sa amelioration sa NAFLD (Browning et al., 2011; Foster et al., 2010; Kani et al., 2014; Schugar ug Crawford, 2012) . Ang among mga obserbasyon nagpakita nga ang hepatocyte ketogenesis mahimong mag-feedback ug mag-regulate sa TCA cycle flux, anaplerotic flux, phosphoenolpyruvate-derived gluconeogenesis (Cotter et al., 2014), ug bisan glycogen turnover. Ang pagkadaot sa ketogenic nagmando sa acetyl-CoA aron madugangan ang TCA flux, nga sa atay nalambigit sa dugang nga kadaot nga gipataliwala sa ROS (Satapati et al., 2015; Satapati et al., 2012); nagpugos sa pagbalhin sa carbon ngadto sa de novo synthesized lipid species nga mahimong mapamatud-an nga cytotoxic; ug gipugngan ang NADH re-oxidation sa NAD + (Cotter et al., 2014) (Fig. 4). Sa tingub, ang umaabot nga mga eksperimento gikinahanglan aron matubag ang mga mekanismo diin ang paryente nga kakulang sa ketogenic mahimong maladaptive, makatampo sa hyperglycemia, makapukaw sa steatohepatitis, ug kung kini nga mga mekanismo operant sa NAFLD / NASH sa tawo. Ingon nga ang ebidensya sa epidemiological nagsugyot sa ningdaot nga ketogenesis sa panahon sa pag-uswag sa steatohepatitis (Embade et al., 2016; Marinou et al., 2011; M�nnist� et al., 2015; Pramfalk et al., 2015; Safaei et al., 2016). Ang mga terapiya nga nagdugang sa hepatic ketogenesis mahimong mapamatud-an nga makapaayo (Degirolamo et al., 2016; Honda et al., 2016).
Mga Lawas sa Ketone ug Pagkapakyas sa Kasingkasing (HF)
Uban sa usa ka metabolic rate nga milapas sa 400 kcal/kg/adlaw, ug usa ka turnover sa 6-35 kg ATP/adlaw, ang kasingkasing mao ang organ nga adunay pinakataas nga paggasto sa enerhiya ug panginahanglan sa oxidative (Ashrafian et al., 2007; Wang et al., 2010b). Ang kadaghanan sa pagbalhin sa enerhiya sa myocardial nagpuyo sa sulod sa mitochondria, ug 70% niini nga suplay naggikan sa FAO. Ang kasingkasing kay omnivorous ug flexible ubos sa normal nga mga kondisyon, apan ang pathologically remodeling heart (pananglitan, tungod sa hypertension o myocardial infarction) ug ang diabetic nga kasingkasing matag usa mahimong metabolically inflexible (Balasse ug Fery, 1989; BING, 1954; Fukao et al., 2004. ; Lopaschuk et al., 2010; Taegtmeyer et al., 1980; Taegtmeyer et al., 2002; Young et al., 2002). Sa tinuud, ang genetically programmed abnormalities sa cardiac fuel metabolism sa mga modelo sa mouse naghagit sa cardiomyopathy (Carley et al., 2014; Neubauer, 2007). Ubos sa mga kondisyon sa pisyolohikal nga normal nga mga kasingkasing nag-oxidize sa mga lawas sa ketone nga katimbang sa ilang paghatud, sa gasto sa fatty acid ug glucose oxidation, ug ang myocardium mao ang pinakataas nga ketone body consumer kada unit mass (BING, 1954; Crawford et al., 2009; GARLAND et al. ., 1962; Hasselbaink et al., 2003; Jeffrey et al., 1995; Pelletier et al., 2007; Tardif et al., 2001; Yan et al., 2009). Kung itandi sa oksihenasyon sa fatty acid, ang mga lawas sa ketone labi ka kusog nga episyente, nga naghatag daghang kusog nga magamit alang sa synthesis sa ATP matag molekula sa oxygen nga gipuhunan (P / O ratio) (Kashiwaya et al., 2010; Sato et al., 1995; Veech, 2004) . Ang oksihenasyon sa lawas sa Ketone makahatag usab ug potensyal nga mas taas nga enerhiya kay sa FAO, nga nagtago sa ubiquinone nga na-oxidized, nga nagpataas sa redox span sa electron transport chain ug naghimo sa dugang nga enerhiya nga magamit aron ma-synthetize ang ATP (Sato et al., 1995; Veech, 2004). Ang oksihenasyon sa mga lawas sa ketone mahimo usab nga makapugong sa produksiyon sa ROS, ug sa ingon ang stress sa oxidative (Veech, 2004).
Ang pasiuna nga interbensyon ug obserbasyonal nga mga pagtuon nagpakita sa usa ka potensyal nga salutary nga papel sa mga lawas sa ketone sa kasingkasing. Sa konteksto sa eksperimento nga ischemia / reperfusion injury, ang mga lawas sa ketone naghatag ug potensyal nga mga epekto sa cardioprotective (Al-Zaid et al., 2007; Wang et al., 2008), posible tungod sa pagdugang sa mitochondrial abundance sa kasingkasing o up-regulation sa mahinungdanon nga oxidative phosphorylation mga tigpataliwala (Snorek et al., 2012; Zou et al., 2002). Gipakita sa bag-ong mga pagtuon nga ang paggamit sa lawas sa ketone nagdugang sa pagkapakyas sa mga kasingkasing sa mga ilaga (Aubert et al., 2016) ug mga tawo (Bedi et al., 2016), nga nagsuporta sa nauna nga mga obserbasyon sa mga tawo (BING, 1954; Fukao et al., 2000; Janardhan et al., 2011; Longo et al., 2004; Rudolph ug Schinz, 1973; Tildon ug Cornblath, 1972). Ang sirkulasyon nga mga konsentrasyon sa lawas sa ketone nadugangan sa mga pasyente sa pagkapakyas sa kasingkasing, sa direkta nga katimbang sa pagpuno sa mga pressure, mga obserbasyon kansang mekanismo ug kahulogan nagpabilin nga wala mahibal-an (Kupari et al., 1995; Lommi et al., 1996; Lommi et al., 1997; Neely et al. ., 1972), apan ang mga ilaga nga adunay pinili nga kakulangan sa SCOT sa cardiomyocytes nagpakita sa gipadali nga pathological ventricular remodeling ug mga pirma sa ROS agig tubag sa surgically induced pressure overload injury (Schugar et al., 2014).
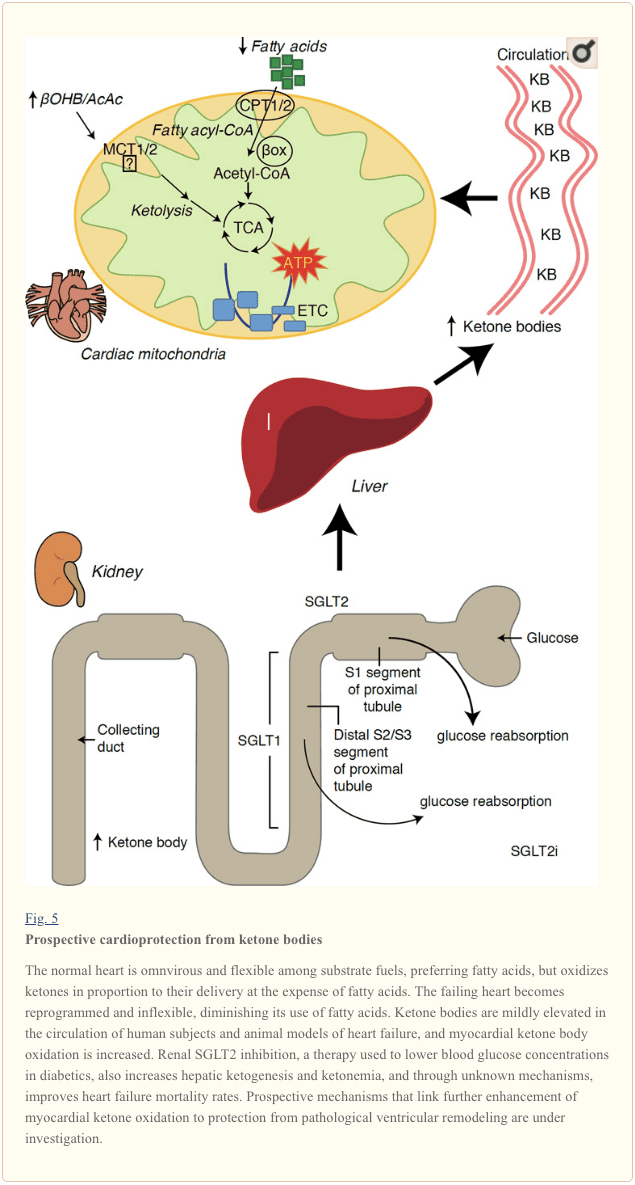
Ang bag-o nga makaiikag nga mga obserbasyon sa diabetes therapy nagpadayag sa usa ka potensyal nga sumpay tali sa myocardial ketone metabolism ug pathological ventricular remodeling (Fig. 5). Ang pagpugong sa renal proximal tubular sodium/glucose co-transporter 2 (SGLT2i) nagdugang sa sirkulasyon sa ketone nga konsentrasyon sa lawas sa mga tawo (Ferrannini et al., 2016a; Inagaki et al., 2015) ug mga ilaga (Suzuki et al., 2014) pinaagi sa pagtaas hepatic ketogenesis (Ferrannini et al., 2014; Ferrannini et al., 2016a; Katz ug Leiter, 2015; Mudaliar et al., 2015). Talagsaon, labing menos usa niini nga mga ahente ang nakunhuran ang pagpaospital sa HF (pananglitan, ingon gipadayag sa pagsulay sa EMPA-REG OUTCOME), ug gipauswag ang pagkamatay sa cardiovascular (Fitchett et al., 2016; Sonesson et al., 2016; Wu et al., 2016a. ; Zinman et al., 2015). Samtang ang mga mekanismo sa drayber luyo sa mapuslanon nga mga resulta sa HF ngadto sa nalambigit nga SGLT2i nagpabilin nga aktibong gidebatehan, ang benepisyo sa pagkaluwas lagmit nga multifactorial, lagmit nga naglakip sa ketosis apan usab salutary nga mga epekto sa gibug-aton, presyon sa dugo, glucose ug uric acid nga lebel, arterial stiffness, ang sympathetic nervous system, osmotic diuresis / pagkunhod sa gidaghanon sa plasma, ug pagtaas sa hematocrit (Raz ug Cahn, 2016; Vallon ug Thomson, 2016). Sa tingub, ang ideya nga ang terapyutik nga pagdugang sa ketonemia bisan sa mga pasyente sa HF, o kadtong adunay taas nga peligro sa pagpalambo sa HF, nagpabilin nga kontrobersyal apan ubos sa aktibong imbestigasyon sa pre-clinical ug clinical studies (Ferrannini et al., 2016b; Kolwicz et al., 2016; Lopaschuk ug Verma, 2016; Mudaliar et al., 2016; Taegtmeyer, 2016).
Mga Lawas sa Ketone sa Biology sa Kanser
Ang mga koneksyon tali sa mga lawas sa ketone ug kanser paspas nga mitumaw, apan ang mga pagtuon sa mga modelo sa hayop ug mga tawo nakahatag ug lainlaing mga konklusyon. Tungod kay ang metabolismo sa ketone mao ang dinamiko ug nutrient state responsive, kini makadani sa pagpadayon sa biolohikal nga mga koneksyon sa kanser tungod sa potensyal alang sa tukma-gigiyahan nutritional terapiya. Ang mga selula sa kanser moagi sa metabolic reprogramming aron mapadayon ang paspas nga pagdaghan ug pagtubo sa selula (DeNicola ug Cantley, 2015; Pavlova ug Thompson, 2016). Ang klasikal nga epekto sa Warburg sa metabolismo sa selula sa kanser naggikan sa dominanteng papel sa glycolysis ug lactic acid fermentation aron mabalhin ang enerhiya ug mabayran ang ubos nga pagsalig sa oxidative phosphorylation ug limitado nga mitochondrial respiration (De Feyter et al., 2016; Grabacka et al., 2016; Kang et al., 2015; Poff et al., 2014; Shukla et al., 2014). Ang glucose carbon nag-una nga gitumong pinaagi sa glycolysis, ang pentose phosphate nga agianan, ug lipogenesis, nga dungan nga naghatag mga intermediate nga gikinahanglan alang sa pagpalapad sa biomass sa tumor (Grabacka et al., 2016; Shukla et al., 2014; Yoshii et al., 2015). Ang pagpahiangay sa mga selula sa kanser sa kakulangan sa glucose mahitabo pinaagi sa abilidad sa pagpahimulos sa alternatibong tinubdan sa sugnod, lakip ang acetate, glutamine, ug aspartate (Jaworski et al., 2016; Sullivan et al., 2015). Pananglitan, ang limitado nga pag-access sa pyruvate nagpadayag sa abilidad sa mga selula sa kanser sa pag-convert sa glutamine ngadto sa acetyl-CoA pinaagi sa carboxylation, pagmintinar sa mga panginahanglan sa kusog ug anabolic (Yang et al., 2014). Ang usa ka makapaikag nga pagpahiangay sa mga selula sa kanser mao ang paggamit sa acetate isip sugnod (Comerford et al., 2014; Jaworski et al., 2016; Mashimo et al., 2014; Wright ug Simone, 2016; Yoshii et al., 2015). Ang acetate usa usab ka substrate alang sa lipogenesis, nga kritikal alang sa pagdaghan sa selula sa tumor, ug ang pag-angkon niini nga lipogenic conduit nalangkit sa mas mubo nga survival sa pasyente ug mas dako nga palas-anon sa tumor (Comerford et al., 2014; Mashimo et al., 2014; Yoshii et al. ., 2015).
Ang mga non-cancer nga mga selula dali nga nagbalhin sa ilang gigikanan sa enerhiya gikan sa glucose ngadto sa mga lawas sa ketone sa panahon sa pagkawala sa glucose. Kini nga plasticity mahimong mas variable sa taliwala sa mga matang sa kanser cell, apan sa vivo implanted utok tumors oxidized [2,4-13C2]-?OHB sa usa ka susama nga degree sa palibot sa utok tissue (De Feyter et al., 2016). Ang �Reverse Warburg effect� o �duha ka compartment tumor metabolism� nga mga modelo nag-hypothesize nga ang mga selula sa kanser nag-aghat sa ?OHB nga produksiyon sa kasikbit nga mga fibroblast, nga naghatag sa panginahanglan sa enerhiya sa tumor cell (Bonuccelli et al., 2010; Martinez-Outschoorn et al., 2012) . Sa atay, ang pagbalhin sa mga hepatocytes gikan sa ketogenesis ngadto sa ketone oxidation sa hepatocellular carcinoma (hepatoma) nga mga selula nahiuyon sa pagpaaktibo sa BDH1 ug SCOT nga mga kalihokan nga naobserbahan sa duha ka hepatoma cell lines (Zhang et al., 1989). Sa tinuud, ang mga selula sa hepatoma nagpahayag sa OXCT1 ug BDH1 ug nag-oxidize sa mga ketone, apan kung ang serum gigutom (Huang et al., 2016). Sa laing bahin, ang tumor cell ketogenesis gisugyot usab. Ang dinamikong pagbalhin sa ketogenic gene expression gipakita sa panahon sa cancerous nga pagbag-o sa colonic epithelium, usa ka tipo sa selula nga kasagarang nagpahayag sa HMGCS2, ug usa ka bag-o nga taho nagsugyot nga ang HMGCS2 mahimong usa ka prognostic marker sa dili maayo nga prognosis sa colorectal ug squamous cell carcinomas (Camarero et al., 2006; Chen et al., 2016). Kung kini nga asosasyon nanginahanglan o naglambigit sa ketogenesis, o usa ka function sa paglamdag sa bulan sa HMGCS2, nagpabilin nga matino. Sa kasukwahi, dayag nga ?OHB produksyon sa melanoma ug glioblastoma mga selula, stimulated sa PPAR? agonist fenofibrate, nalangkit sa pag-aresto sa pagtubo (Grabacka et al., 2016). Ang dugang nga mga pagtuon gikinahanglan aron mahibal-an ang mga papel sa HMGCS2 / SCOT nga ekspresyon, ketogenesis, ug oksihenasyon sa ketone sa mga selula sa kanser.
Labaw sa natad sa metabolismo sa gasolina, ang mga ketone bag-o lang nalambigit sa biology sa selula sa kanser pinaagi sa mekanismo sa pagsenyas. Ang pag-analisa sa BRAF-V600E + melanoma nagpakita sa OCT1-dependent nga induction sa HMGCL sa usa ka oncogenic BRAF-dependent nga paagi (Kang et al., 2015). Ang pagdugang sa HMGCL gi-correlate sa mas taas nga konsentrasyon sa cellular AcAc, nga sa baylo nagpauswag sa interaksyon sa BRAFV600E-MEK1, nga nagpadako sa pagsenyas sa MEK-ERK sa usa ka feed-forward loop nga nagduso sa pagdaghan ug pagtubo sa selula sa tumor. Kini nga mga obserbasyon nagpatungha sa makaiikag nga pangutana sa umaabot nga extrahepatic ketogenesis nga nagsuporta sa usa ka mekanismo sa pagsenyas (tan-awa usab ang ?OHB isip usa ka tigpataliwala sa signal ug Mga Kontrobersiya sa extrahepatic ketogenesis). Mahinungdanon usab nga tagdon ang mga independente nga epekto sa AcAc, d-?OHB, ug l-?OHB sa metabolismo sa kanser, ug kung gikonsiderar ang HMGCL, ang leucine catabolism mahimo usab nga madaot.
Ang mga epekto sa ketogenic diets (tan-awa usab ang Therapeutic nga paggamit sa ketogenic diet ug exogenous ketone nga mga lawas) sa kanser nga mga modelo sa mananap nagkalainlain (De Feyter et al., 2016; Klement et al., 2016; Meidenbauer et al., 2015; Poff et al. ., 2014; Seyfried et al., 2011; Shukla et al., 2014). Samtang ang mga asosasyon sa epidemiological taliwala sa hilabihang katambok, kanser, ug ketogenic diets gidebatehan (Liskiewicz et al., 2016; Wright ug Simone, 2016), usa ka meta-analysis nga naggamit sa ketogenic diets sa mga modelo sa mananap ug sa mga pagtuon sa tawo nagsugyot og usa ka salutary nga epekto sa survival, uban sa Ang mga benepisyo nga lagmit nga nalambigit sa kadako sa ketosis, oras sa pagsugod sa pagkaon, ug lokasyon sa tumor (Klement et al., 2016; Woolf et al., 2016). Ang pagtambal sa mga selula sa kanser sa pancreatic nga adunay mga lawas sa ketone (d-?OHB o AcAc) nagpugong sa pagtubo, pagdaghan ug glycolysis, ug usa ka ketogenic nga pagkaon (81% kcal fat, 18% nga protina, 1% nga carbohydrate) gipakunhod sa timbang sa tumor sa vivo, glycemia, ug nadugangan ang kaunuran ug gibug-aton sa lawas sa mga hayop nga adunay gitanum nga kanser (Shukla et al., 2014). Ang susamang mga resulta naobserbahan gamit ang metastatic glioblastoma cell model sa mga ilaga nga nakadawat og ketone supplementation sa pagkaon (Poff et al., 2014). Sa kasukwahi, ang usa ka ketogenic nga pagkaon (91% kcal fat, 9% nga protina) nagdugang sa sirkulasyon sa ?OHB nga konsentrasyon ug pagkunhod sa glycemia�apan walay epekto sa bisan unsang tumor volume o survival duration sa glioma-bearing nga mga ilaga (De Feyter et al., 2016). Ang indeks sa glucose sa ketone gisugyot isip usa ka clinical indicator nga nagpauswag sa metabolic management sa ketogenic diet-induced brain cancer therapy sa mga tawo ug mga ilaga (Meidenbauer et al., 2015). Sa tingub, ang mga tahas sa metabolismo sa lawas sa ketone ug mga lawas sa ketone sa biology sa kanser makapaukyab tungod kay ang matag usa adunay mga kapilian nga mga kapilian sa pagtambal, apan ang sukaranan nga mga aspeto nagpabilin nga gipatin-aw, nga adunay tin-aw nga mga impluwensya nga mitumaw gikan sa usa ka matrix sa mga variable, lakip ang (i) mga kalainan tali sa exogenous ketone mga lawas batok sa ketogenic diet, (ii) cancer cell type, genomic polymorphism, grade, ug stage; ug (iii) timing ug gidugayon sa pagkaladlad sa ketotic state.

Ang ketogenesis gihimo sa mga lawas sa ketone pinaagi sa pagkahugno sa mga fatty acid ug ketogenic amino acid. Kini nga biochemical nga proseso naghatag kusog sa lain-laing mga organo, ilabi na ang utok, ubos sa mga sirkumstansya sa pagpuasa isip tubag sa usa ka dili magamit nga glucose sa dugo. Ang mga lawas sa ketone kasagarang gihimo sa mitochondria sa mga selula sa atay. Samtang ang ubang mga selula makahimo sa paghimo sa ketogenesis, sila dili sama ka epektibo sa pagbuhat niini sama sa mga selula sa atay. Tungod kay ang ketogenesis mahitabo sa mitochondria, ang mga proseso niini gi-regulate nga independente. Dr. Alex Jimenez DC, CCST Insight
Therapeutic Application sa Ketogenic Diet ug Exogenous Ketone Lawas
Ang mga aplikasyon sa ketogenic diets ug ketone nga mga lawas isip mga himan sa pagtambal mitungha usab sa dili-kanser nga mga konteksto lakip na ang hilabihang katambok ug NAFLD / NASH (Browning et al., 2011; Foster et al., 2010; Schugar ug Crawford, 2012); pagkapakyas sa kasingkasing (Huynh, 2016; Kolwicz et al., 2016; Taegtmeyer, 2016); neurological ug neurodegenerative nga sakit (Martin et al., 2016; McNally ug Hartman, 2012; Rho, 2015; Rogawski et al., 2016; Yang ug Cheng, 2010; Yao et al., 2011); inborn errors sa metabolismo (Scholl-B�rgi et al, 2015); ug pasundayag sa ehersisyo (Cox et al., 2016). Ang kaepektibo sa mga ketogenic diet labi nga gipabilhan sa therapy sa epileptic seizure, labi na sa mga pasyente nga resistensya sa droga. Kadaghanan sa mga pagtuon nag-evaluate sa mga ketogenic diet sa mga pasyente sa pediatric, ug nagpadayag sa usa ka ~ 50% nga pagkunhod sa frequency sa seizure human sa 3 nga mga bulan, nga adunay mas maayo nga pagka-epektibo sa pinili nga mga sindrom (Wu et al., 2016b). Ang kasinatian mas limitado sa hamtong nga epilepsy, apan ang susama nga pagkunhod makita, nga adunay mas maayo nga tubag sa symptomatic generalized epilepsy nga mga pasyente (Nei et al., 2014). Ang nagpahipi nga mga mekanismo sa anti-convulsant nagpabilin nga dili klaro, bisan kung ang mga postulated hypotheses naglakip sa pagkunhod sa paggamit sa glucose / glycolysis, reprogrammed nga transportasyon sa glutamate, dili direkta nga epekto sa ATP-sensitive nga potassium channel o adenosine A1 receptor, pag-usab sa sodium channel isoform expression, o mga epekto sa circulating hormones lakip na ang leptin ( Lambrechts et al., 2016; Lin et al., 2017; Lutas ug Yellen, 2013). Nagpabilin nga dili klaro kung ang anti-convulsant nga epekto sa panguna tungod sa mga lawas sa ketone, o tungod sa mga sangputanan sa metaboliko sa kaskad sa mga diyeta nga ubos ang carbohydrate. Bisan pa, ang mga ketone ester (tan-awa sa ubos) nagpakita nga nagpataas sa threshold sa pag-atake sa mga modelo sa hayop nga gihagit nga mga pag-atake (Ciarlone et al., 2016; D'Agostino et al., 2013; Viggiano et al., 2015).
Ang estilo sa Atkins ug ketogenic, ubos nga carbohydrate nga mga diyeta kasagarang giisip nga dili maayo, ug mahimong hinungdan sa constipation, hyperuricemia, hypocalcemia, hypomagnesemia, mosangpot sa nephrolithiasis, ketoacidosis, hinungdan sa hyperglycemia, ug pagpataas sa sirkulasyon nga kolesterol ug libreng fatty acid nga konsentrasyon (Bisschop et al., 2001. ; Kossoff ug Hartman, 2012; Kwiterovich et al., 2003; Suzuki et al., 2002). Tungod niini nga mga hinungdan, ang dugay nga pagsunod naghatag mga hagit. Ang mga pagtuon sa rodent kasagarang naggamit sa usa ka talagsaon nga macronutrient distribution (94% kcal fat, 1% kcal carbohydrate, 5% kcal protein, Bio-Serv F3666), nga makapukaw sa usa ka lig-on nga ketosis. Bisan pa, ang pagdugang sa sulud sa protina, bisan hangtod sa 10% nga kcal makapakunhod sa ketosis, ug ang 5% nga pagdili sa protina sa kcal naghatag makapalibog nga mga epekto sa metaboliko ug pisyolohikal. Kini nga pormulasyon sa pagkaon nahurot usab ang choline, usa pa nga variable nga nag-impluwensya sa pagkadaling makuha sa kadaot sa atay, ug bisan ang ketogenesis (Garbow et al., 2011; Jornayvaz et al., 2010; Kennedy et al., 2007; Pissios et al., 2013; Schugar. ug uban pa, 2013). Ang mga epekto sa dugay nga pagkonsumo sa mga ketogenic diet sa mga ilaga nagpabilin nga dili kompleto nga gihubit, apan ang bag-ong mga pagtuon sa mga ilaga nagpadayag sa normal nga pagkaluwas ug ang pagkawala sa mga marka sa kadaot sa atay sa mga ilaga sa mga ketogenic diet sa ilang kinabuhi, bisan kung ang metabolismo sa amino acid, paggasto sa enerhiya, ug pagsenyas sa insulin. gimarkahan nga gi-reprogram (Douris et al., 2015).
Ang mga mekanismo nga nagdugang sa ketosis pinaagi sa mga mekanismo nga alternatibo sa ketogenic diets naglakip sa paggamit sa ingestible ketone body precursors. Ang pagdumala sa exogenous nga mga lawas sa ketone mahimong makamugna og usa ka talagsaon nga kahimtang sa pisyolohikal nga wala makita sa normal nga pisyolohiya, tungod kay ang sirkulasyon sa glucose ug mga konsentrasyon sa insulin medyo normal, samtang ang mga selyula mahimo nga magluwas sa pagsuyup ug paggamit sa glucose. Ang mga lawas sa ketone sa ilang kaugalingon adunay mubo nga katunga sa kinabuhi, ug ang pagtunaw o pagpuga sa sodium ?OHB nga asin aron makab-ot ang terapyutik nga ketosis makapukaw sa usa ka dili maayo nga pagkarga sa sodium. Ang R/S-1,3-butanediol kay dili makahilo nga dialcohol nga daling ma-oxidize sa atay aron makahatag ug d/l-?OHB (Desrochers et al., 1992). Sa lahi nga mga konteksto sa eksperimento, kini nga dosis gihatag adlaw-adlaw ngadto sa mga ilaga o mga ilaga sulod sa pito ka semana, nga naghatag og circulating ?OHB nga mga konsentrasyon nga hangtod sa 5 mM sulod sa 2 ka oras sa administrasyon, nga stable sa labing menos usa ka dugang nga 3h (D' Agostino et al., 2013). Ang partial nga pagsumpo sa pag-inom sa pagkaon naobserbahan sa mga ilaga nga gihatag R/S-1,3-butanediol (Carpenter ug Grossman, 1983). Dugang pa, tulo ka kemikal nga lahi nga ketone ester (KEs), (i) monoester sa R-1,3-butanediol ug d-?OHB (R-3-hydroxybutyl R-?OHB); (ii) glyceryl-tris-?OHB; ug (iii) R, S-1,3-butanediol acetoacetate diester, kay kaylap usab nga gitun-an (Brunengraber, 1997; Clarke et al., 2012a; Clarke et al., 2012b; Desrochers et al., 1995a; Desrochers et al. ., 1995b; Kashiwaya et al., 2010). Usa ka kinaiyanhon nga bentaha sa kanhi mao nga ang 2 moles sa physiological d-?OHB gihimo kada mole sa KE, human sa esterase hydrolysis sa tinai o atay. Ang kaluwasan, pharmacokinetics, ug pagkamatugtanon labing kaylap nga gitun-an sa mga tawo nga nag-ingest sa R-3-hydroxybutyl R-?OHB, sa mga dosis nga hangtod sa 714 mg/kg, nga naghatag sa naglibot nga d-?OHB nga konsentrasyon hangtod sa 6 mM (Clarke et al., 2012a; Cox et al., 2016; Kemper et al., 2015; Shivva et al., 2016). Sa mga ilaga, kini nga KE nagpamenos sa caloric intake ug sa total nga kolesterol sa plasma, nagpukaw sa brown nga adipose tissue, ug nagpauswag sa resistensya sa insulin (Kashiwaya et al., 2010; Kemper et al., 2015; Veech, 2013). Gipakita sa bag-o nga mga nahibal-an nga sa panahon sa pag-ehersisyo sa nabansay nga mga atleta, ang R-3-hydroxybutyl R-?OHB ingestion mikunhod skeletal muscle glycolysis ug plasma lactate concentrations, nagdugang sa intramuscular triacylglycerol oxidation, ug nagpreserbar sa kaunoran glycogen content, bisan pa sa dihang ang co-ingested carbohydrate stimulated insulin secretion ( Cox et al., 2016). Ang dugang nga pag-uswag niining mga makaiikag nga mga resulta gikinahanglan, tungod kay ang pag-uswag sa pasundayag sa pag-ehersisyo sa paglahutay kasagaran gimaneho sa usa ka lig-on nga tubag sa KE sa 2/8 nga mga hilisgutan. Bisan pa, kini nga mga resulta nagsuporta sa mga klasikal nga pagtuon nga nagpakita sa usa ka pagpalabi alang sa ketone oxidation sa ubang mga substrates (GARLAND et al., 1962; Hasselbaink et al., 2003; Stanley et al., 2003; Valente-Silva et al., 2015), lakip sa panahon sa pag-ehersisyo, ug nga ang mga nabansay nga mga atleta mahimong mas andam sa paggamit sa mga ketones (Johnson et al., 1969a; Johnson ug Walton, 1972; Winder et al., 1974; Winder et al., 1975). Sa katapusan, ang mga mekanismo nga mahimong mosuporta sa gipaayo nga performance sa pag-ehersisyo human sa patas nga caloric intake (lainlain nga giapod-apod sa mga macronutrients) ug patas nga mga rate sa pagkonsumo sa oxygen nagpabilin nga matino.
Umaabot nga Panglantaw
Sa higayon nga kadaghanan gi-stigmatize isip usa ka overflow nga agianan nga makahimo sa pagtigum sa makahilo nga mga emissions gikan sa fat combustion sa carbohydrate restricted states (ang �ketotoxic� paradigm), ang bag-o nga mga obserbasyon nagsuporta sa ideya nga ang ketone body metabolism nagsilbi sa salutary nga mga papel bisan sa carbohydrate-laden states, nagbukas sa �ketohormetic. � pangagpas. Samtang ang facile nutritional ug pharmacological approaches sa pagmaniobra sa ketone metabolism naghimo niini nga usa ka madanihon nga terapyutik nga target, agresibo nga pose apan mabinantayon nga mga eksperimento nagpabilin sa mga batakan ug translational research laboratories. Ang wala matubag nga mga panginahanglan mitumaw sa mga dominyo sa pagtino sa papel sa pagpauswag sa metabolismo sa ketone sa pagkapakyas sa kasingkasing, sobra nga katambok, NAFLD / NASH, type 2 diabetes, ug kanser. Ang kasangkaran ug epekto sa 'non-canonical' nga mga papel sa pagsenyas sa mga lawas sa ketone, lakip ang regulasyon sa mga PTM nga lagmit nga nagbalik-balik ug nagpadayon sa mga agianan sa metaboliko ug pagsenyas, nanginahanglan labi ka lawom nga pagsuhid. Sa katapusan, ang extrahepatic ketogenesis mahimong magbukas sa makaiikag nga paracrine ug autocrine nga mga mekanismo sa pagsenyas ug mga oportunidad nga maimpluwensyahan ang co-metabolism sa sulod sa sistema sa nerbiyos ug mga tumor aron makab-ot ang mga katuyoan sa pagtambal.
mga sakripisyo
Ncbi.nlm.nih.gov/pmc/articles/PMC5313038/
Mga footnote
Sa konklusyon, ang mga lawas sa ketone gihimo sa atay aron magamit ingon usa ka gigikanan sa enerhiya kung wala’y igo nga glucose nga dali magamit sa lawas sa tawo. Ang ketogenesis mahitabo kung adunay mubu nga lebel sa glucose sa dugo, labi na pagkahuman nahurot ang ubang mga tindahan sa cellular carbohydrate. Ang katuyoan sa artikulo sa ibabaw mao ang paghisgot sa mga multi-dimensional nga papel sa mga lawas sa ketone sa metabolismo sa gasolina, pagsenyas, ug mga terapiya. Ang sakup sa among kasayuran limitado sa mga isyu sa kahimsog sa chiropractic ug spinal. Aron hisgutan ang hilisgutan, palihug ayaw pagpangutana kang Dr. Jimenez o kontaka kami sa�915-850-0900�.
Gi-curate ni Dr. Alex Jimenez
Gi-refer gikan sa:�Ncbi.nlm.nih.gov/pmc/articles/PMC5313038/

Dugang nga Hisgutan sa Hilisgutan:�Acute Back Pain
Sakit sa likod�usa sa labing kaylap nga hinungdan sa pagkabaldado ug wala’y trabaho nga mga adlaw sa tibuuk kalibutan. Ang sakit sa bukobuko hinungdan sa ikaduha nga kasagarang hinungdan sa pagbisita sa opisina sa doktor, nga mas daghan kaysa mga impeksyon sa taas nga respiratoryo. Gibana-bana nga 80 porsyento sa populasyon ang makasinati og sakit sa likod labing menos kausa sa tibuok nilang kinabuhi. Ang dugokan maoy usa ka komplikadong gambalay nga gilangkoban sa mga bukog, lutahan, ligaments, ug kaunuran, ug uban pang humok nga mga tisyu. Mga kadaot ug/o nagkagrabe nga kondisyon, sama sa�herniated discs, mahimong mosangpot sa mga sintomas sa sakit sa likod. Ang mga samad sa sports o mga aksidente sa awto sa kasagaran mao ang labing kanunay nga hinungdan sa sakit sa bukobuko, bisan pa, usahay ang pinakasimple nga mga paglihok mahimong adunay sakit nga mga sangputanan. Maayo na lang, ang alternatibong mga opsyon sa pagtambal, sama sa pag-atiman sa chiropractic, makatabang sa pagpagaan sa sakit sa likod pinaagi sa paggamit sa mga pag-adjust sa taludtod ug mga pagmaniobra sa manwal, nga sa katapusan makapauswag sa paghupay sa kasakit. �

DUGANG DUGANG | IMPORTANTE NGA TOPIC: Girekomenda ang El Paso, TX Chiropractor
***
Propesyonal nga Sakop sa Pagpraktis *
Ang kasayuran dinhi sa "Daghang-Dimensyon nga Papel sa mga Lawas nga Ketone" wala gituyo nga pulihan ang usa-sa-usa nga relasyon sa usa ka kwalipikado nga propesyonal sa pag-atiman sa kahimsog o lisensyado nga doktor ug dili tambag medikal. Giawhag ka namon nga maghimo mga desisyon sa pag-atiman sa kahimsog base sa imong panukiduki ug pakigtambayayong sa usa ka kwalipikado nga propesyonal sa pag-atiman sa kahimsog.
Impormasyon sa Blog ug Kasangkaran nga mga Panaghisgot
Ang among sakup sa kasayuran limitado sa Chiropractic, musculoskeletal, pisikal nga mga tambal, kaayohan, nga nag-amot sa etiological mga kasamok sa viscerosomatic sulod sa mga klinikal nga presentasyon, kaubang somatovisceral reflex clinical dynamics, subluxation complex, sensitibo nga mga isyu sa panglawas, ug/o functional nga mga artikulo sa medisina, mga hilisgutan, ug mga diskusyon.
Among gihatag ug present klinikal nga kolaborasyon uban sa mga espesyalista gikan sa lainlaing mga disiplina. Ang matag espesyalista gidumala sa ilang propesyonal nga sakup sa praktis ug ilang hurisdiksyon sa lisensya. Gigamit namon ang mga protocol sa kahimsog ug kahimsog aron matambal ug suportahan ang pag-atiman sa mga kadaot o sakit sa musculoskeletal system.
Ang among mga video, mga post, mga hilisgutan, mga hilisgutan, ug mga insight naglangkob sa mga klinikal nga butang, mga isyu, ug mga hilisgutan nga may kalabutan ug direkta o dili direkta nga nagsuporta sa among klinikal nga sakup sa praktis.*
Ang among opisina makatarunganon nga misulay sa paghatag suporta nga mga citation ug nahibal-an ang may kalabutan nga pagtuon sa panukiduki o mga pagtuon nga nagsuporta sa among mga post. Naghatag kami mga kopya sa pagsuporta sa mga pagtuon sa panukiduki nga magamit sa mga board sa pagdumala ug publiko kung gihangyo.
Nasabtan namon nga gisakup namon ang mga butang nga nanginahanglan dugang nga pagpatin-aw kung giunsa kini makatabang sa usa ka piho nga plano sa pag-atiman o protokol sa pagtambal; busa, aron sa dugang nga paghisgot sa hilisgutan sa taas, palihug ayaw pangutana Dr. Alex Jimenez, DC, O kontaka kami sa 915-850-0900.
Ania kami aron matabangan ka ug ang imong pamilya.
Panalangin
Dr. Alex Jimenez D.C., MSACP, RN*, CCST, Ang IFMCP*, CIFM*, ATN*
email: coach@elpasofunctionalmedicine.com
Lisensyado isip Doktor sa Chiropractic (DC) sa Texas & New Mexico*
Lisensya sa Texas DC # TX5807, New Mexico DC Lisensya # NM-DC2182
Lisensyado isip Rehistradong Nars (RN*) in Florida
Lisensya sa Florida nga RN Lisensya # RN9617241 (Kontrol No. 3558029)
Compact nga kahimtang: Multi-State License: Gitugotan sa Pagpraktis sa Mga Estado sa 40*
Alex Jimenez DC, MSACP, RN* CIFM*, IFMCP*, ATN*, CCST
Akong Digital Business Card