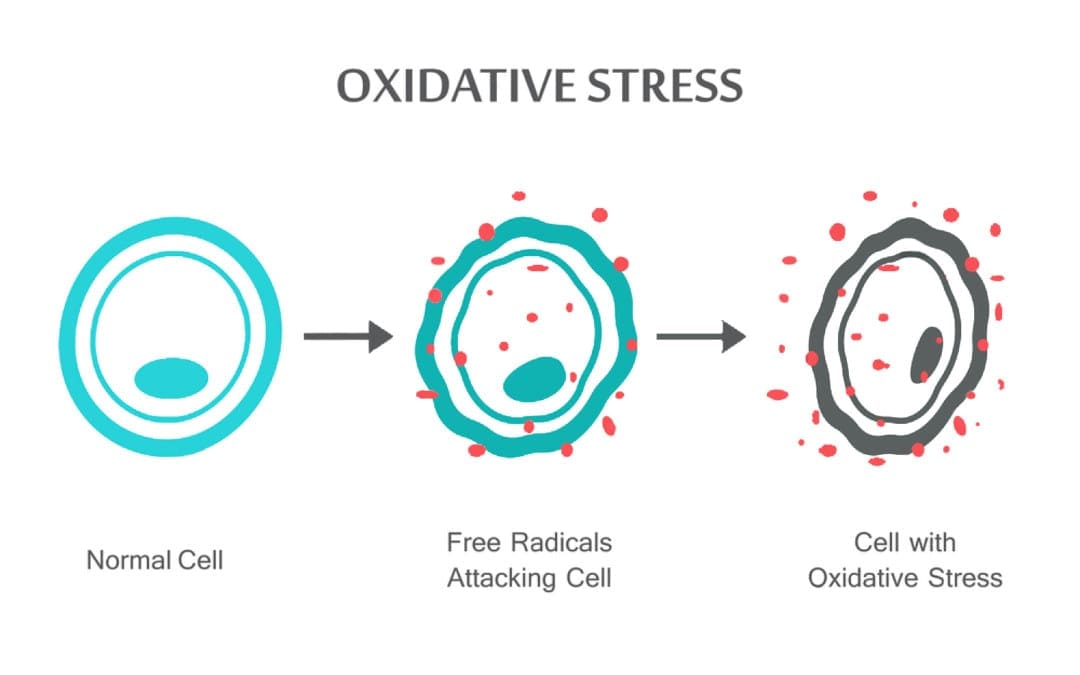
Ang Chiropractor nga nakabase sa siyensya nga si Dr. Alexander Jimenez nagtan-aw sa oxidative stress, unsa kini, kung giunsa kini makaapekto sa lawas ug sa antioxidant nga depensa aron masulbad ang sitwasyon.
Esra Birben PhD, 1 Umit Murat Sahiner MD, 1 Cansin Sackesen MD, 1 Serpil Erzurum MD, 2 ug Omer Kalayci, MD1
Abstract: Ang reactive oxygen species (ROS) gihimo sa mga buhing organismo isip resulta sa normal nga metabolismo sa cellular ug mga hinungdan sa palibot, sama sa mga pollutant sa hangin o aso sa sigarilyo. Ang ROS kay reaktibo kaayo nga mga molekula ug makadaot sa mga istruktura sa selula sama sa carbohydrates, nucleic acid, lipid, ug mga protina ug makausab sa ilang mga gimbuhaton. Ang pagbalhin sa balanse tali sa mga oxidant ug mga antioxidant pabor sa mga oxidant gitawag nga �oxidative stress.� Ang regulasyon sa pagkunhod ug pag-oxidizing (redox) nga kahimtang hinungdanon alang sa cell viability, pagpaaktibo, pagdaghan, ug pag-obra sa organ. Ang mga aerobic nga organismo adunay mga integrated antioxidant system, nga naglakip sa enzymatic ug non-enzymatic antioxidants nga kasagaran epektibo sa pagbabag sa makadaot nga mga epekto sa ROS. Bisan pa, sa mga kondisyon sa pathological, ang mga sistema sa antioxidant mahimong mabug-atan. Ang oxidative stress nakatampo sa daghang mga pathological nga kondisyon ug sakit, lakip na ang cancer, neurological disorder, atherosclerosis, hypertension, ischemia/perfusion, diabetes, acute respiratory distress syndrome, idiopathic pulmonary fibrosis, chronic obstructive pulmonary disease, ug asthma. Sa kini nga pagrepaso, among gisumada ang cellular oxidant ug antioxidant nga mga sistema ug hisgutan ang mga epekto sa cellular ug mga mekanismo sa stress sa oxidative.
Key Words: antioxidant, oxidant, oxidative stress, reactive oxygen species, redox
(WAO Journal 2012; 5:9–19)
Ang reactive oxygen species (ROS) gihimo sa mga buhing organismo isip resulta sa normal nga metabolismo sa selula. Sa ubos ngadto sa kasarangang konsentrasyon, naglihok sila sa mga proseso sa pisyolohikal nga selula, apan sa taas nga konsentrasyon, nagpatungha kini ug dili maayong mga kausaban sa mga sangkap sa selula, sama sa lipid, protina, ug DNA.1â6 Ang pagbalhin sa balanse tali sa oxidant/antioxidant pabor sa mga oxidant gitawag nga �oxidative stress.� Ang oxidative stress makatampo sa daghang pathological nga kondisyon, lakip na ang cancer, neurological disorders,7�10 atherosclerosis, hypertension, ischemia/perfusion,11�14 diabetes, acute respiratory distress syndrome, idiopathic pulmonary fibrosis, chronic obstructive pulmonary disease ,15 ug asthma.16–21 Ang mga aerobic nga organismo adunay integrated antioxidant system,� nga naglakip sa enzymatic ug nonenzymatic antioxidants nga kasagaran epektibo sa pagbabag sa makadaot nga mga epekto sa ROS. Bisan pa, sa mga kondisyon sa pathological, ang mga sistema sa antioxidant mahimong mabug-atan. Sa kini nga pagrepaso, among gisumada ang cellular oxidant ug antioxidant nga mga sistema ug regulasyon sa pagkunhod ug pag-oxidizing (redox) nga estado sa kahimsog ug sakit nga estado.
Kaundan
MGA OXIDANTS
Endogenous nga mga Tinubdan sa ROS
Ang ROS gihimo gikan sa molecular oxygen isip resulta sa normal nga metabolismo sa cellular. Ang ROS mahimong bahinon sa 2 ka grupo: free radicals ug nonradicals. Ang mga molekula nga adunay usa o daghan pa nga wala magkapares nga mga electron ug sa ingon naghatag reaktibo sa molekula gitawag nga mga libre nga radikal. Kung ang 2 nga mga libre nga radikal nakigbahin sa ilang mga wala gipares nga mga electron, ang mga nonradical nga porma gihimo. Ang 3 ka dagkong ROS nga adunay pisyolohikal nga kahulogan mao ang superoxide anion (O22.), hydroxyl radical (OH), ug hydrogen peroxide (H2O2). Ang ROS gisumada sa Talaan 1.
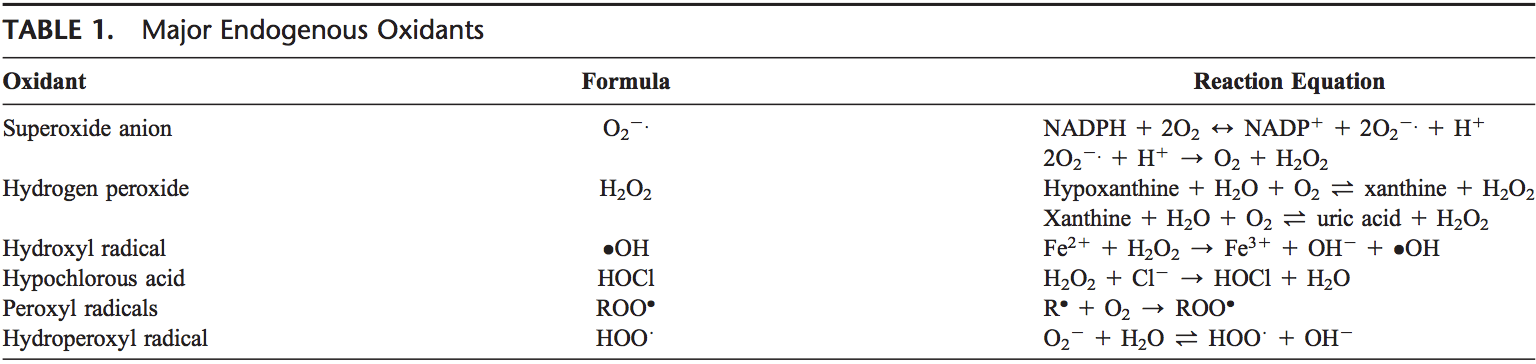
Ang superoxide anion naporma pinaagi sa pagdugang sa 1 ka electron sa molekular nga oxygen.22 Kini nga proseso gipataliwala sa nicotine adenine dinucleotide phosphate [NAD(P)H] oxidase o xanthine oxidase o sa mitochondrial electron transport system. Ang nag-unang dapit alang sa paghimo sa superoxide anion mao ang mitochondria, ang makinarya sa selula sa paghimo sa adenosine triphosphate. Kasagaran, ang mga electron gibalhin pinaagi sa mitochondrial electron transport chain alang sa pagkunhod sa oksiheno ngadto sa tubig, apan gibana-bana nga 1 ngadto sa 3% sa tanang mga electron ang mogawas gikan sa sistema ug makahimo og superoxide. Ang NAD(P)H oxidase makita sa polymorphonuclear leukocytes, monocytes, ug macrophage. Sa phagocytosis, kini nga mga selyula nagpatunghag usa ka pagbuto sa superoxide nga motultol sa kalihokan sa bactericidal. Ang superoxide nakabig ngadto sa hydrogen peroxide pinaagi sa aksyon sa superoxide dismutase (SODs, EC 1.15.1.1). Ang hydrogen peroxide dali nga mokaylap sa lamad sa plasma. Ang hydrogen peroxide giprodyus usab sa xanthine oxidase, amino acid oxidase, ug NAD(P)H oxidase23,24 ug sa mga peroxisome pinaagi sa pagkonsumo sa molekular nga oxygen sa metabolic reactions. Sa sunodsunod nga mga reaksyon nga gitawag ug Haber Weiss ug Fenton nga mga reaksyon, ang H2O2 mahimong mabungkag ngadto sa OH2 sa presensya sa transmission metal sama sa Fe21 o Cu21.25.
Fe31 +�.O2�?Fe2 +�O2 Haber Weiss
Fe2 + �H2O2�?Fe3 +�OH�+ .OH Fenton reaksyon
Ang O 2 mismo maka-react usab sa H2 O2 ug makamugna og OH.26,27 Ang hydroxyl radical mao ang pinaka-reaktibo sa ROS ug makadaot sa mga protina, lipid, ug carbohydrates ug DNA. Makasugod usab kini sa lipid peroxidation pinaagi sa pagkuha og electron gikan sa polyunsaturated fatty acids.
Ang mga granulocytic enzymes dugang nga nagpalapad sa reaktibidad sa H2O2 pinaagi sa eosinophil peroxidase ug myeloperoxidase (MPO). Sa activate neutrophils, H2O2 gigamit sa MPO. Sa presensya sa chloride ion, ang H2O2 nakabig ngadto sa hypochlorous acid (HOCl). Ang HOCl kay oxidative kaayo ug adunay importante nga papel sa pagpatay sa mga pathogens sa mga agianan sa hangin.28 Bisan pa, ang HOCl mahimo usab nga mo-react sa DNA ug mag-aghat sa mga interaksyon sa protina sa DNA ug makahimo og pyrimidine oxidation nga mga produkto ug makadugang sa chloride sa mga base sa DNA.29,30 Eosinophil peroxidase ug MPO usab makatampo sa oxidative stress pinaagi sa pagbag-o sa mga protina pinaagi sa halogenations, nitration, ug protina cross-links pinaagi sa tyrosyl radicals.31-33
Ang ubang mga free radical nga nakuha sa oxygen mao ang peroxyl radicals (ROO$). Ang pinakasimple nga porma niini nga mga radical mao ang hydro-peroxyl radical (HOO$) ug adunay papel sa fatty acid peroxidation. Ang mga libreng radicals mahimong mag-trigger sa lipid peroxidation chain reactions pinaagi sa pagkuha sa hydrogen atom gikan sa side-chain methylene carbon. Ang lipid radical dayon mo-react sa oxygen aron makahimo og peroxyl radical. Ang peroxyl radical nagpasiugda sa kadena nga reaksyon ug nag-usab sa polyunsaturated fatty acids ngadto sa lipid hydroperoxides. Ang mga lipid hydroperoxide dili kaayo lig-on ug dali nga madunot sa mga sekondaryang produkto, sama sa aldehydes (sama sa 4-hydroxy-2,3-nonenal) ug malondialdehydes (MDAs). Ang Isoprostanes maoy laing grupo sa mga produkto sa lipid peroxidation nga namugna pinaagi sa peroxidation sa arachidonic acid ug nakit-an usab nga nataas sa plasma ug condensates sa gininhawa sa mga asthmatics.34,35 Ang peroxidation sa mga lipid makasamok sa integridad sa mga membrana sa selula ug mosangpot sa pag-usab sa istruktura sa lamad.
Ang hydrogen peroxide, superoxide radical, oxidized glutathione (GSSG), MDAs, isoprostanes, carbonyls, ug nitrotyrosine daling masukod gikan sa plasma, dugo, o bronchoalveolar lavage samples isip biomarker sa oxidation pinaagi sa standardized assays.
Exogenous nga Tinubdan sa mga Oksiheno
Aso sa Sigarilyo
Ang aso sa sigarilyo adunay daghang mga oxidant ug free radicals ug organic compounds, sama sa superoxide ug nitric oxide.36 Dugang pa, ang inhalation sa aso sa sigarilyo ngadto sa baga nagpalihok usab sa pipila ka endogenous nga mga mekanismo, sama sa pagtipon sa neutrophils ug macrophage, nga dugang nga nagdugang sa kadaot sa oxidant. .
Pagkaladlad sa Ozone
Ang pagkaladlad sa ozone mahimong hinungdan sa peroxidation sa lipid ug mag-aghat sa pag-agos sa mga neutrophil ngadto sa epithelium sa agianan sa hangin. Ang hamubo nga pagkaladlad sa ozone hinungdan usab sa pagpagawas sa mga tigpataliwala sa pagpanghubag, sama sa MPO, eosinophil cationic protein ug usab lactate dehydrogenase ug albumin.37 Bisan sa himsog nga mga hilisgutan, ang pagkaladlad sa ozone hinungdan sa pagkunhod sa mga function sa pulmonary.38 Gipakita ni Cho et al39 nga particulate matter (pagsagol sa solid nga mga partikulo ug mga tinulo nga likido nga gisuspinde sa hangin) nag-catalyze sa pagkunhod sa oxygen.
Hyperoxia
Ang hyperoxia nagtumong sa mga kondisyon nga mas taas ang lebel sa oksiheno kay sa normal nga partial pressure sa oxygen sa baga o ubang mga tisyu sa lawas. Kini modala ngadto sa mas dako nga produksyon sa reactive oxygen ug nitrogen species.40,41
Ionizing Radiation
Ang ionizing radiation, sa presensya sa O2, nag-convert sa hydroxyl radical, superoxide, ug organic radicals ngadto sa hydrogen peroxide ug organic hydroperoxides. Kini nga mga hydroperoxide nga mga espisye mo-react sa redox active metal ions, sama sa Fe ug Cu, pinaagi sa Fenton reactions ug sa ingon nag-aghat sa oxidative stress.42,43 Narayanan et al44 nagpakita nga ang mga fibroblast nga na-expose sa alpha particles adunay dakong pagtaas sa intracellular O2 2. ug H2O2 produksyon pinaagi sa plasma membrane-bound NADPH oxidase.44 Signal transduction molecules, sama sa extracellular signal-regulated kinase 1 ug 2 (ERK1/2), c-Jun N-terminal kinase (JNK), ug p38, ug transcription factors, sama sa activator protein-1 (AP-1), nuclear factor-kB (NF-kB), ug p53, gi-activate, nga moresulta sa pagpahayag sa radiation response’related genes.45-50 Ultraviolet A (UVA) nga mga photon nag-trigger sa oxidative reactions pinaagi sa excitation sa endogenous photosensitizers, sama sa porphyrins, NADPH oxidase, ug riboflavin. Ang 8-Oxo-7,8- dihydroguanine (8-oxoGua) mao ang nag-unang UVA-mediated DNA oxidation nga produkto nga naporma pinaagi sa oksihenasyon sa OH radical, 1-electron oxidants, ug singlet oxygen nga kasagarang mo-react sa guanine.51 Ang pagporma sa guanine radical cation sa nahilit nga DNA gipakita nga episyenteng mahitabo pinaagi sa direktang epekto sa ionizing radiation.52,53 Human sa exposure sa ionizing radiation, ang intracellular level sa glutathione (GSH) mikunhod sulod sa hamubo nga termino apan unya misaka pag-usab.54
Bug-at nga Metal Ion
Ang mabug-at nga metal nga mga ion, sama sa iron, copper, cadmium, mercury, nickel, lead, ug arsenic, mahimong mag-aghat sa pagmugna og mga reactive radicals ug hinungdan sa pagkadaot sa cellular pinaagi sa pagkunhod sa mga kalihokan sa enzyme pinaagi sa lipid peroxidation ug reaksyon sa nuclear proteins ug DNA.55
Usa sa labing importante nga mga mekanismo sa metal-mediated free radical generation mao ang pinaagi sa Fenton-type nga reaksyon. Ang superoxide ion ug hydrogen peroxide mahimong makig-interact sa transisyon nga mga metal, sama sa iron ug copper, pinaagi sa metal catalyzed Haber Weiss/Fenton reaction aron maporma ang OH radicals.
Metal31 1 $O2 /Metal21 1 O2 Haber Weiss Metal21 1 H2 O2 /Metal31 1 OH 2 1 $OH Fenton reaction
Gawas sa Fenton-type ug HaberWeiss-type nga mga mekanismo, ang pipila ka mga metal nga ion mahimong direktang mo-react sa mga molekula sa cellular aron makamugna og mga free radical, sama sa thiol radical, o mag-aghat sa cell signaling pathways. Kini nga mga radical mahimo usab nga mo-react sa ubang mga thiol molekula aron makamugna og O22.. O22. nakabig ngadto sa H2O2, nga maoy hinungdan sa dugang nga oxygen radical generation. Ang ubang mga metal, sama sa arsenite, nag-aghat sa pagporma sa ROS sa dili direkta pinaagi sa pagpaaktibo sa mga radikal nga sistema sa paghimo sa mga selula.56
Ang arsenic kay makahilo kaayo nga elemento nga naggama ug lain-laing ROS, apil ang superoxide (O2 2), singlet oxygen (1O2), peroxyl radical (ROO ), nitric oxide (NO ), hydrogen peroxide (H2O2), ug dimethylarsinic peroxyl radicals [( CH3)2AsOO ].57�59 Arsenic (III) compounds makapugong sa antioxidant enzymes, ilabina sa GSH-dependent enzymes, sama sa glutathione-S-transferases (GSTs), glutathione peroxidase (GSH-Px), ug GSH reductase, pinaagi sa bind - sa ilang sulfhydryl (�SH) nga mga grupo.60,61
Ang tingga nagdugang sa lipid peroxidation.62 Mahinungdanon nga pagkunhod sa kalihokan sa tissue SOD ug utok GPx ang gitaho pagkahuman sa pagkaladlad sa tingga.63,64 Ang pag-ilis sa zinc, nga nagsilbi nga cofactor sa daghang mga enzyme pinaagi sa tingga, nagdala sa pagka-aktibo sa ingon nga mga enzyme. Ang pagkaladlad sa tingga mahimong hinungdan sa pagdili sa GST pinaagi sa pag-apekto sa mga thiol sa tisyu.
Ang ROS nga namugna sa metal-catalyzed nga mga reaksyon makausab sa mga base sa DNA. Tulo ka base substitutions, G / C, G / T, ug C / T, mahimong mahitabo ingon sa usa ka resulta sa oxidative kadaot sa metal ions, sama sa Fe21, Cu21, ug Ni21. Gipakita ni Reid et al65 nga ang G / C kasagarang gihimo sa Fe21 samtang ang pagpuli sa C / T sa Cu21 ug Ni21.
MGA ANTIOXIDANTS
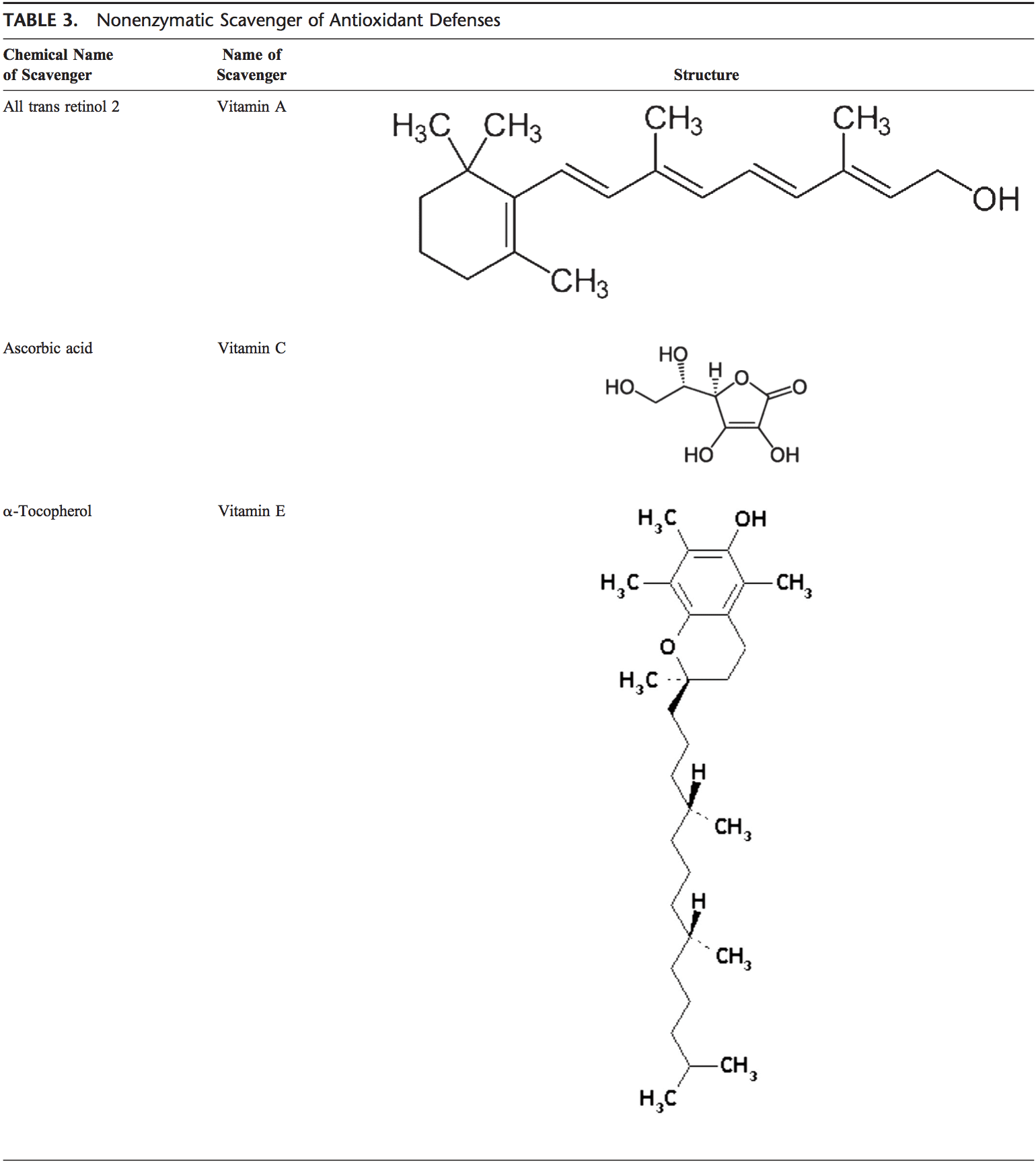
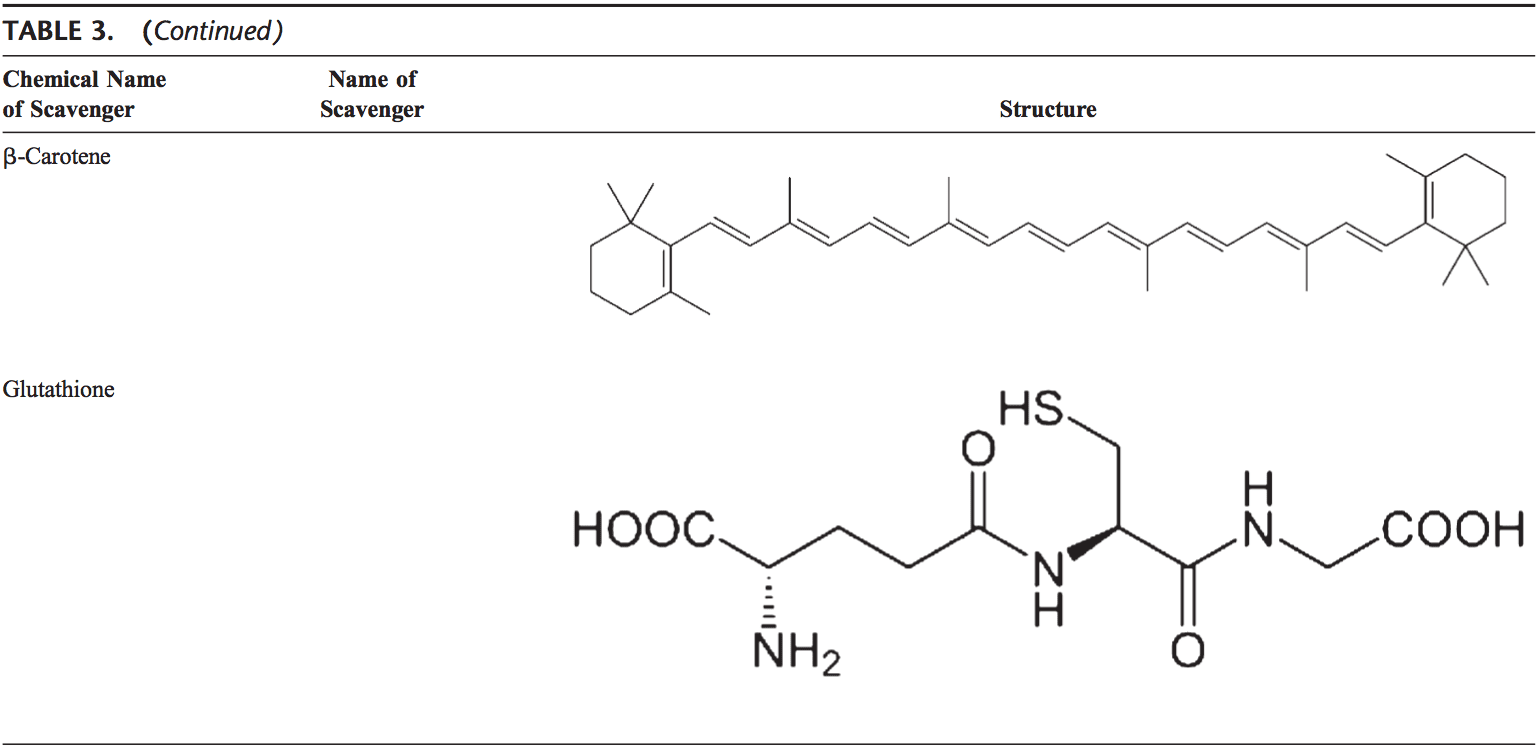
Ang lawas sa tawo nasangkapan sa lainlaing mga antioxidant nga nagsilbi aron mabalanse ang epekto sa mga oxidant. Alang sa tanan nga praktikal nga katuyoan, kini mahimong bahinon sa 2 nga mga kategorya: enzymatic (Table 2) ug nonenzymatic (Table 3).
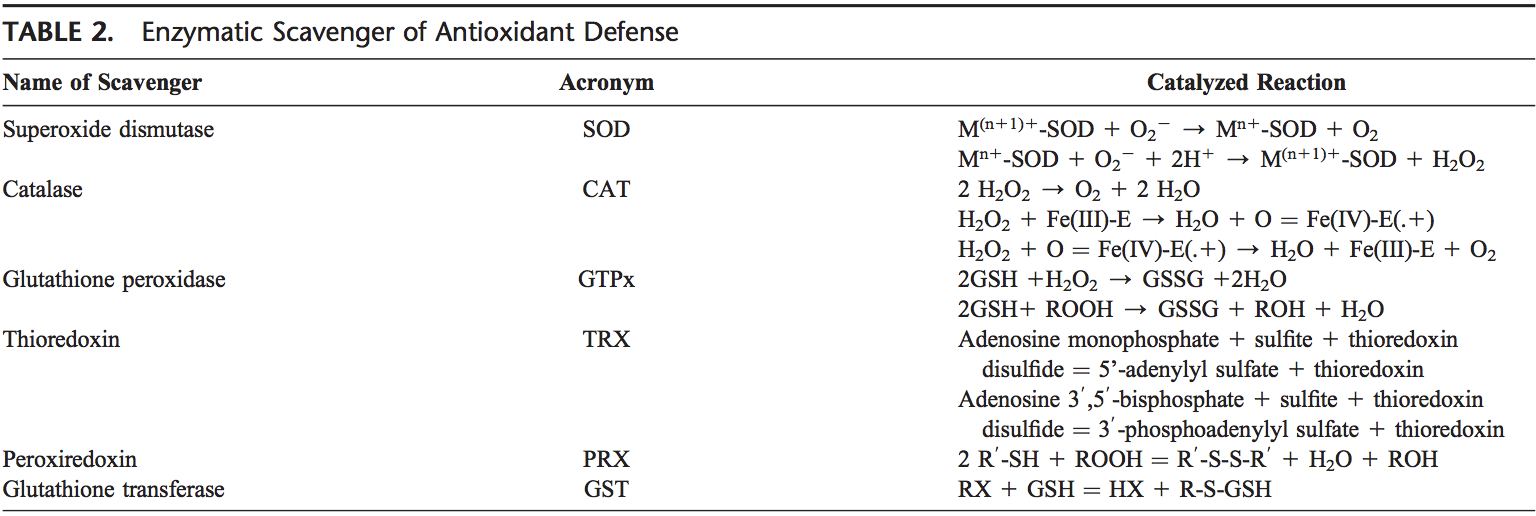
Enzymatic Antioxidants
Ang mga mayor nga enzymatic antioxidants sa baga mao ang SODs (EC 1.15.1.11), catalase (EC 1.11.1.6), ug GSH-Px (EC 1.11.1.9). Dugang pa niining mga mayor nga enzyme, ang ubang mga antioxidant, lakip ang heme oxygenase-1 (EC 1.14.99.3), ug redox proteins, sama sa thioredoxins (TRXs, EC 1.8.4.10), peroxiredoxins (PRXs, EC 1.11.1.15), ug glutaredoxins , nakit-an usab nga adunay hinungdanon nga papel sa mga depensa sa pulmonary antioxidant.
Tungod kay ang superoxide mao ang nag-unang ROS nga gihimo gikan sa lain-laing mga tinubdan, ang dismutation niini pinaagi sa SOD mao ang labing importante alang sa matag cell. Ang tanan nga 3 ka porma sa SOD, nga mao, CuZn-SOD, Mn-SOD, ug EC-SOD, kaylap nga gipahayag sa baga sa tawo. Ang Mn-SOD na-localize sa mitochondria matrix. Ang EC-SOD panguna nga na-localize sa extracellular matrix, labi na sa mga lugar nga adunay taas nga kantidad sa type I collagen fibers ug sa palibot sa pulmonary ug systemic nga mga sudlanan. Nakit-an usab kini sa bronchial epithelium, alveolar epithelium, ug alveolar macrophage.66,67 Sa kinatibuk-an, ang CuZn-SOD ug Mn-SOD sa kasagaran gihunahuna nga molihok isip bulk scavengers sa superoxide radicals. Ang medyo taas nga lebel sa EC-SOD sa baga nga adunay espesipikong pagbugkos sa mga sangkap sa extracellular matrix mahimong magrepresentar sa usa ka sukaranan nga sangkap sa proteksyon sa matrix sa baga.68
Ang H2O2 nga gihimo sa aksyon sa mga SOD o ang aksyon sa mga oxidases, sama sa xanthine oxidase, gipaubos sa tubig pinaagi sa catalase ug ang GSH-Px. Ang Catalase anaa isip usa ka tetramer nga gilangkuban sa 4 ka managsama nga monomer, nga ang matag usa adunay usa ka heme nga grupo sa aktibo nga dapit. Ang pagkadaot sa H2O2 nahimo pinaagi sa pagkakabig tali sa 2 ka conformation sa catalase-ferricatalase (iron coordinated to water) ug compound I (iron complexed with oxygen atom). Ang Catalase usab nagbugkos sa NADPH isip usa ka pagkunhod nga katumbas aron mapugngan ang oxidative inactivation sa enzyme (pagporma sa compound II) pinaagi sa H2O2 ingon nga kini gipaubos sa tubig.69
Ang mga enzyme sa redox cycle nga responsable sa pagkunhod sa H2O2 ug lipid hydroperoxides (namugna isip resulta sa membrane lipid peroxidation) naglakip sa GSH-Pxs.70 Ang GSH-Pxs usa ka pamilya sa tetrameric enzymes nga adunay talagsaon nga amino acid selenocysteine sulod sa aktibo nga mga site ug mogamit og mga low-molecular-weight nga thiols, sama sa GSH, aron makunhuran ang H2O2 ug lipid peroxide ngadto sa katugbang nga mga alkohol niini. Upat ka GSH-Pxs ang gihulagway, gi-encode sa lain-laing mga gene: GSH-Px-1 (cellular GSH-Px) kay ubiquitous ug makapamenos sa H2O2 ug fatty acid peroxides, apan dili esterified peroxyl lipids.71 Esterified lipids gipakunhod sa membrane-bound GSH -Px-4 (phospholipid hydroperoxide GSH-Px), nga makagamit ug ubay-ubay nga lainlain nga mga low-molecular-weight nga thiols isip mga katumbas nga pagkunhod. Ang GSH-Px-2 (gastrointestinal GSH-Px) na-localize sa gastrointestinal epithelial cells diin nagsilbi kini nga pagpakunhod sa dietary peroxides.72 GSH-Px-3 (extracellular GSH-Px) mao lamang ang miyembro sa GSH-Px nga pamilya nga nagpuyo sa ang extracellular compartment ug gituohan nga usa sa pinaka importante nga extracellular antioxidant enzyme sa mammals. Niini, ang extracellular GSH-Px ang labing kaylap nga gisusi sa baga sa tawo.73
Dugang pa, ang paglabay sa H2O2 suod nga nalangkit sa ubay-ubay nga thiol-containing enzymes, nga mao, TRXs (TRX1 ug TRX2), thioredoxin reductases (EC 1.8.1.9) (TRRs), PRXs (nga thioredoxin peroxidases), ug glutaredoxins.74
Duha ka TRX ug TRR ang gihulagway sa mga selula sa tawo, nga anaa sa cytosol ug mitochondria. Sa baga, ang TRX ug TRR gipahayag sa bronchial ug alveolar epithelium ug macrophage. Unom ka lainlaing PRX ang nakit-an sa mga selula sa tawo, nga lahi sa ilang ultrastructural compartmentalization. Gipadayag sa mga eksperimento nga pagtuon ang kamahinungdanon sa PRX VI sa pagpanalipod sa alveolar epithelium. Ang baga sa tawo nagpahayag sa tanang PRXs sa bronchial epithelium, alveolar epithelium, ug macrophage.75 Ang PRX V bag-o lang nakit-an nga naglihok isip usa ka peroxynitrite reductase, 76 nga nagpasabot nga kini mahimong molihok isip usa ka potensyal nga protective compound sa pagpalambo sa ROS-mediated lung injury .77
Kasagaran sa kini nga mga antioxidant mao ang kinahanglanon sa NADPH ingon usa ka pagkunhod nga katumbas. Ang NADPH nagmintinar sa catalase sa aktibong porma ug gigamit isip cofactor sa TRX ug GSH reductase (EC 1.6.4.2), nga nag-convert sa GSSG ngadto sa GSH, usa ka co-substrate alang sa GSH-Pxs. Ang intracellular NADPH, sa baylo, namugna pinaagi sa pagkunhod sa NADP1 pinaagi sa glucose-6-phosphate dehydrogenase, ang una ug rate-limiting enzyme sa pentose phosphate nga agianan, sa panahon sa pagkakabig sa glucose-6-phosphate ngadto sa 6-phosphogluconolactone. Pinaagi sa pagmugna sa NADPH, ang glucose-6-phosphate dehydrogenase usa ka kritikal nga determinant sa cytosolic GSH buffering capacity (GSH/GSSG) ug, busa, mahimong isipon nga usa ka importante, regulatory antioxidant enzyme.78,79
GSTs (EC 2.5.1.18), laing antioxidant enzyme nga pamilya, dili aktibo sa secondary metabolites, sama sa unsaturated aldehydes, epoxides, ug hydroperoxides. Tulo ka dagkong pamilya sa GST ang gihulagway: cytosolic GST, mitochondrial GST,80,81 ug membrane-associated microsomal GST nga adunay papel sa eicosanoid ug GSH metabolism.82 Pito ka klase sa cytosolic GST ang giila sa mammalian, gitudlo nga Alpha, Mu, Pi, Sigma, Theta, Omega, ug Zeta.83-86 Atol sa dili-stressed nga mga kondisyon, ang klase Mu ug Pi GST nakig-interact sa kinases Ask1 ug JNK, matag usa, ug nagpugong niini nga mga kinase.87'89 Gipakita nga ang GSTP1 nagbulag gikan sa Ang JNK agig tubag sa oxidative stress.89 Ang GSTP1 pisikal usab nga nakig-uban sa PRX VI ug nagdala ngadto sa pagkaayo sa PRX enzyme nga kalihokan pinaagi sa glutathionylation sa oxidized protein.90
Nonenzymatic Antioxidants
Ang nonenzymatic antioxidants naglakip sa ubos nga molekular-timbang nga mga compound, sama sa bitamina (bitamina C ug E), b-carotene, uric acid, ug GSH, usa ka tripeptide (Lg-glutamyl-L-cysteinyl-L-glycine) nga naglangkob sa usa ka thiol ( sulfhydryl) nga grupo.
Bitamina C (Ascorbic Acid)
Ang matunaw sa tubig nga bitamina C (ascorbic acid) naghatag sa intracellular ug extracellular aqueous-phase nga kapasidad nga antioxidant sa panguna pinaagi sa pag-scavenging sa oxygen free radicals. Gibag-o niini ang mga free radical sa bitamina E balik sa bitamina E. Ang lebel sa plasma niini gipakita nga nagkunhod sa edad.91,92
Bitamina E (a-Tocopherol)
Ang matunaw nga lipid nga bitamina E gikonsentrar sa hydrophobic interior site sa cell membrane ug mao ang panguna nga depensa batok sa kadaot sa lamad nga gipahinabo sa oxidant. Ang Vitamin E nagdonar og electron sa peroxyl radical, nga gihimo atol sa lipid peroxidation. Ang a-Tocopherol mao ang labing aktibo nga porma sa bitamina E ug ang mayor nga lamad nga gigapos nga antioxidant sa selula. Ang Vitamin E nag-trigger sa apoptosis sa mga selula sa kanser ug nagpugong sa mga free radical formations.93
Glutathione
Ang GSH kay daghan kaayo sa tanang cell compartment ug mao ang mayor nga matunaw nga antioxidant. GSH/GSSG ratio mao ang usa ka mayor nga determinant sa oxidative stress. Gipakita sa GSH ang iyang antioxidant nga mga epekto sa daghang paagi.94 Kini nag-detoxify sa hydrogen peroxide ug lipid peroxide pinaagi sa aksyon sa GSH-Px. Gidonar sa GSH ang iyang electron sa H2O2 aron makunhuran kini ngadto sa H2O ug O2. Ang GSSG gipaubos na usab ngadto sa GSH pinaagi sa GSH reductase nga naggamit sa NAD(P)H isip electron donor. Importante usab ang GSH-Pxs alang sa pagpanalipod sa cell membrane gikan sa lipid peroxidation. Ang pagkunhod sa glutathione nagdonar sa mga proton sa mga lipid sa lamad ug nanalipod kanila gikan sa mga pag-atake sa oxidant.95
Ang GSH usa ka cofactor alang sa daghang mga detoxifying enzyme, sama sa GSH-Px ug transferase. Kini adunay papel sa pagbag-o sa bitamina C ug E balik sa ilang aktibo nga porma. Gipanalipdan sa GSH ang mga selula batok sa apoptosis pinaagi sa pagpakig-uban sa proapoptotic ug antiapoptotic signaling pathways.94 Kini usab nag-regulate ug nagpalihok sa daghang mga transcription nga mga hinungdan, sama sa AP-1, NF-kB, ug Sp-1.
Carotenoids (b-Carotene)
Ang mga carotenoid mga pigment nga makita sa mga tanum. Sa panguna, ang b-carotene nakit-an nga mo-react sa peroxyl (ROO), hydroxyl (OH), ug superoxide (O22.) radicals.96 Ang mga carotenoid nagpakita sa ilang antioxidant nga mga epekto sa ubos nga oxygen partial pressure apan mahimong adunay pro-oxidant nga epekto sa mas taas nga oxygen. konsentrasyon.97 Ang duha ka carotenoids ug retinoic acids (RAs) makahimo sa pag-regulate sa transcription factors.98 b-Carotene mopugong sa oxidant-induced NF-kB activation ug interleukin (IL)-6 ug tumor necrosis factor-a production. Ang mga carotenoid usab makaapekto sa apoptosis sa mga selula. Ang mga antiproliferative nga epekto sa RA gipakita sa daghang mga pagtuon. Kini nga epekto sa RA gipataliwala sa panguna sa mga receptor sa retinoic acid ug lainlain sa mga tipo sa selula. Sa mammary carcinoma cells, ang retinoic acid receptor gipakita nga maka-trigger sa growth inhibition pinaagi sa pag-aghat sa cell cycle arrest, apoptosis, o pareho.99,100
ANG EPEKTO SA OXIDATIVE STRESS: GENETIC, PHYSIOLOGICAL, & BIOCHEMICAL MECHANISMS
Ang oxidative stress mahitabo kung ang balanse tali sa antioxidants ug ROS mabalda tungod sa pagkahurot sa mga antioxidant o pagtipon sa ROS. Kung mahitabo ang stress sa oxidative, ang mga selyula mosulay sa pagsumpo sa mga epekto sa oxidant ug ibalik ang balanse sa redox pinaagi sa pagpaaktibo o pagpahilom sa mga gene nga nag-encode sa mga defensive enzyme, transkripsyon nga mga hinungdan, ug istruktura nga protina. sa importante nga determinants sa oxidative stress sa lawas. Ang mas taas nga produksiyon sa ROS sa lawas mahimong magbag-o sa istruktura sa DNA, moresulta sa pagbag-o sa mga protina ug lipid, pagpaaktibo sa daghang mga hinungdan sa transkripsyon nga gipahinabo sa stress, ug paghimo sa mga pro-inflammatory ug anti-inflammatory cytokine.
Mga Epekto sa Oxidative Stress Sa DNA
Ang ROS mahimong mosangpot sa pagbag-o sa DNA sa daghang paagi, nga naglakip sa pagkadaot sa mga base, single-o double-stranded nga DNA break, purine, pyrimidine o sugar-bound modifications, mutation, deletion o translocations, ug cross-linking sa mga protina. Kadaghanan niini nga mga pagbag-o sa DNA (Fig. 1) may kalabutan kaayo sa carcinogenesis, pagtigulang, ug neurodegenerative, cardiovascular, ug autoimmune nga mga sakit. Ang aso sa tabako, redox nga mga metal, ug mga nonredox nga metal, sama sa iron, cadmium, chrome, ug arsenic, nalangkit usab sa carcinogenesis ug pagkatigulang pinaagi sa pagmugna og mga free radical o pagbugkos sa thiol nga mga grupo. Ang pagporma sa 8-OH-G mao ang labing nailhan nga kadaot sa DNA nga nahitabo pinaagi sa oxidative stress ug usa ka potensyal nga biomarker alang sa carcinogenesis.
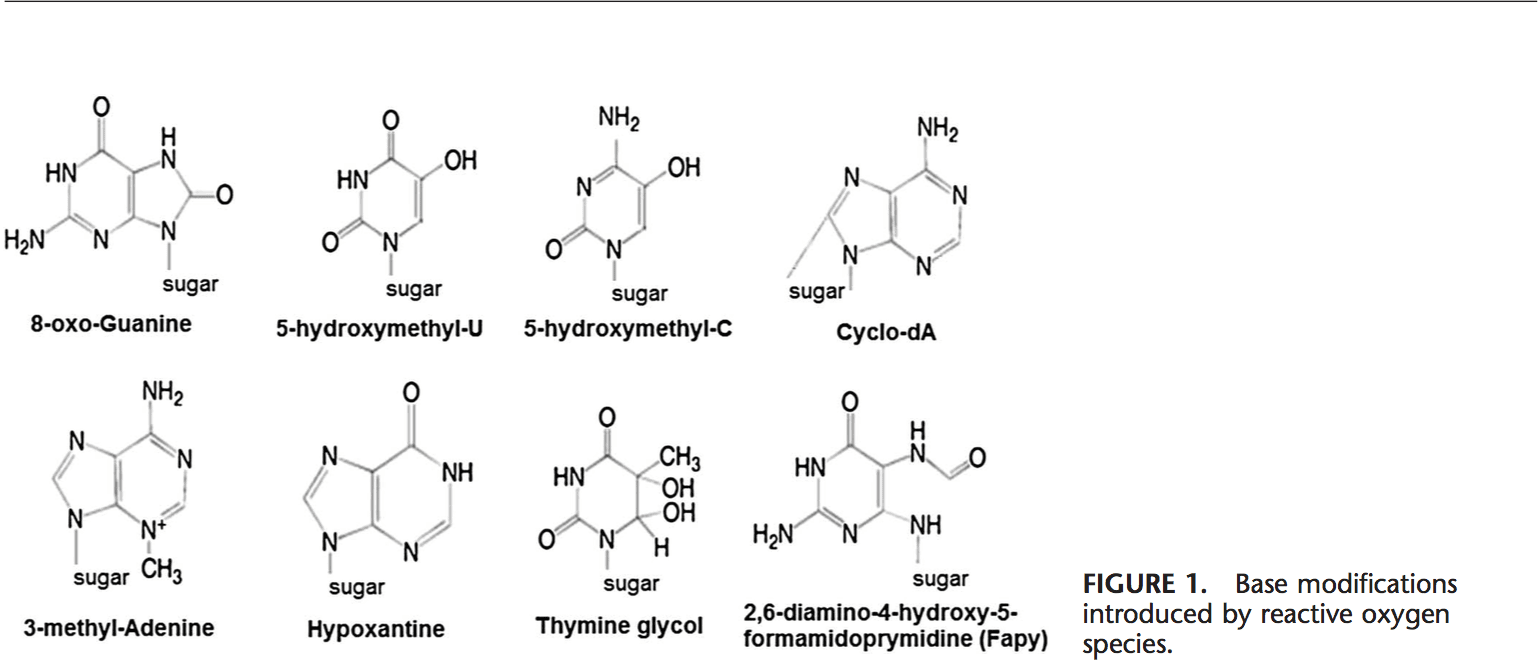
Ang mga rehiyon sa promoter sa mga gene adunay consensus sequence alang sa transcription factor. Kining mga transcription factor�binding sites adunay GC-rich sequence nga daling maatake sa oxidant. Ang pagporma sa 8-OH-G DNA sa transcription factor binding sites makausab sa pagbugkos sa transcription factors ug sa ingon mausab ang ekspresyon sa mga may kalabutan nga mga gene sama sa gipakita sa AP-1 ug Sp-1 nga target sequences.103 Gawas sa 8-OH-G, Ang 8,59 -cyclo-29 -deoxyadenosine (cyclo-dA) gipakita usab nga makapugong sa transkripsyon gikan sa usa ka reporter gene sa usa ka sistema sa selula kon anaa sa kahon sa TATA.104 Ang TATA-binding protein nagpasiugda sa transkripsyon pinaagi sa pag-usab sa bending sa DNA . Ang pagbugkos sa TATA-binding protein mahimong madaot tungod sa presensya sa cyclo-dA.
Ang oxidative stress hinungdan sa pagkawalay kalig-on sa microsatellite (mubo nga tandem repeats) nga mga rehiyon. Ang redox active metal ions, hydroxyl radicals nagdugang sa microsatellite instability.105 Bisan tuod ang single-stranded DNA break tungod sa oxidant injury daling maagwanta sa mga selula, ang double-stranded DNA break nga gipahinabo sa ionizing radiation mahimong dakong hulga sa cell survival.106
Ang methylation sa mga isla sa CpG sa DNA usa ka importante nga mekanismo sa epigenetic nga mahimong moresulta sa pagpahilom sa gene. Ang oxidation sa 5-MeCyt ngadto sa 5-hydroxymethyl uracil (5-OHMeUra) mahimong mahitabo pinaagi sa deamination/oxidation reactions sa thymine o 5-hydroxymethyl cytosine intermediates.107 Dugang pa sa modulating gene expression, ang DNA methylation daw makaapekto usab sa chromatin organization.108 Ang aberrant DNA methylation patterns tungod sa oxidative attacks makaapekto usab sa DNA repair activity.
Mga Epekto Sa Oxidative Stress Sa Lipid
Ang ROS makaaghat sa lipid peroxidation ug makabalda sa lamad nga lipid bilayer nga kahikayan nga mahimong dili aktibo sa membrane-bound receptors ug enzymes ug makadugang sa tissue permeability.109 Ang mga produkto sa lipid peroxidation, sama sa MDA ug unsaturated aldehydes, makahimo sa pagpa-inactivate sa daghang cellular proteins pinaagi sa pagporma sa protina cross -linkages.110�112 4-Hydroxy-2-nonenal hinungdan sa pagkahurot sa intracellular GSH ug pag-aghat sa produksiyon sa peroxide,113,114 pagpaaktibo sa epidermal growth factor receptor,115 ug pagduso sa produksiyon sa fibronectin.116 Lipid peroxidation nga mga produkto, sama sa isoprostanes ug thiobarbituric acid reactive substances , gigamit isip dili direkta nga biomarker sa oxidative stress, ug ang pagtaas sa lebel gipakita sa exhaled breath condensate o bronchoalveolar lavage fluid o baga sa chronic obstructive pulmonary disease nga mga pasyente o mga hinabako.117-119
Mga Epekto sa Oxidative Stress sa Protina
Ang ROS mahimong hinungdan sa pagkabahin sa kadena sa peptide, pagbag-o sa elektrikal nga karga sa mga protina, cross-linking sa mga protina, ug oksihenasyon sa piho nga mga amino acid ug busa modala ngadto sa dugang nga pagkadaling maapektuhan sa proteolysis pinaagi sa pagkadaut sa piho nga mga protease.120 Ang mga residu sa cysteine ug methionine sa mga protina ilabina nga mas daling madala sa oksihenasyon.121 Ang oxidation sa sulfhydryl groups o methionine residues sa mga protina maoy hinungdan sa conformational change, protein unfolding, ug degradation.8,121�123 Ang mga enzyme nga adunay mga metal sa o duol sa ilang aktibo nga mga dapit ilabinang mas sensitibo sa metal catalyzed oxidation. Ang oxidative nga pagbag-o sa mga enzyme gipakita nga makapugong sa ilang mga kalihokan.124,125
Sa pipila ka mga kaso, ang piho nga oksihenasyon sa mga protina mahimong mahitabo. Pananglitan, ang methionine mahimong oxidized methionine sulfoxide126 ug phenylalanine ngadto sa o-tyrosine127; Ang mga grupo sa sulfhydryl mahimong ma-oxidized aron maporma ang mga disulfide bond; 128 ug ang mga grupo sa carbonyl mahimong ipasok sa kilid nga kadena sa mga protina. Ang gamma rays, metal-catalyzed oxidation, HOCl, ug ozone mahimong hinungdan sa pagporma sa carbonyl groups.129
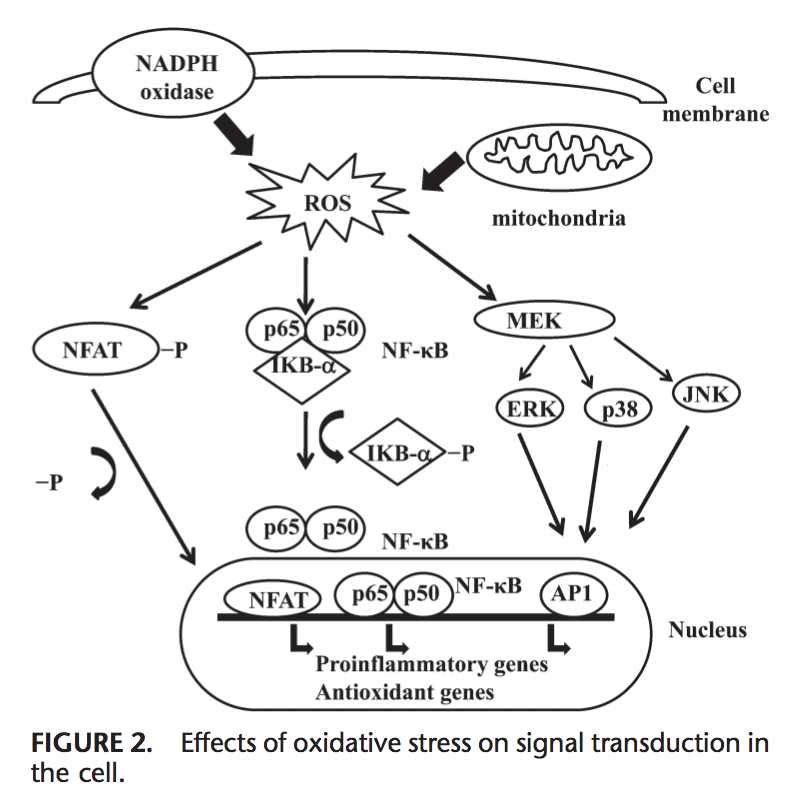
Mga Epekto sa Oxidative Stress sa Signal Transduction
Ang ROS makahimo sa pagpahayag sa daghang mga gene nga nalambigit sa signal transduction.1,130 Ang taas nga ratio sa GSH/GSSG importante alang sa pagpanalipod sa selula gikan sa oxidative nga kadaot. Ang pagkabalda niini nga ratio maoy hinungdan sa pagpaaktibo sa redox sensitive transcription nga mga hinungdan, sama sa NF-kB, AP-1, nukleyar nga hinungdan sa mga activate nga T cells ug hypoxia-inducible factor 1, nga nalangkit sa makapahubag nga tubag. Ang pagpaaktibo sa mga hinungdan sa transkripsyon pinaagi sa ROS makab-ot pinaagi sa mga signal transduction cascades nga nagpadala sa kasayuran gikan sa gawas hangtod sa sulod sa cell. Tyrosine kinase receptors, kadaghanan sa growth factor receptors, sama sa epidermal growth factor receptor, vascular endothelial growth factor receptor, ug receptor alang sa platelet-derived growth factor, protein tyrosine phosphatases, ug serine/threonine kinases maoy mga target sa ROS.131-133 Ang extra-cellular signal-regulated kinases, JNK, ug p38, nga mga membro sa mitogen-activated protein kinase family ug nalambigit sa daghang proseso sa cell lakip na ang proliferation, differentiation, ug apoptosis, mahimo usab nga ma-regulate sa mga oxidant.
Ubos sa mga kondisyon sa stress sa oxidative, ang mga residue sa cysteine sa DNA-binding site sa c-Jun, pipila ka mga subunit sa AP-1, ug ang nagpugong nga kB kinase moagi sa mabalik nga S-glutathiolation. Ang Glutaredoxin ug TRX gikataho nga adunay importante nga papel sa regulasyon sa redox-sensitive signaling pathways, sama sa NF-kB ug AP-1, p38 mitogen-activated protein kinase, ug JNK.134�137
Ang NF-kB mahimong ma-activate agig tubag sa oxidative stress nga mga kondisyon, sama sa ROS, free radicals, ug UV irradiation.138 Phosphorylation of IkB frees NF-kB ug gitugotan kini nga mosulod sa nucleus aron ma-activate ang transcription sa gene.139 Daghang kinase ang adunay gitaho sa phosphorylate IkBs sa serine residues. Kini nga mga kinases mao ang mga target sa mga oxidative signal alang sa pagpaaktibo sa NF-kB.140 Ang pagkunhod sa mga ahente nagpalambo sa NF-kB DNA binding, samtang ang oxidizing agents nagpugong sa DNA binding sa NF-kB. Ang TRX mahimong magbuhat ug 2 ka kaatbang nga mga aksyon sa regulasyon sa NF-kB: sa cytoplasm, gibabagan niini ang pagkadaot sa IkB ug gipugngan ang pagpaaktibo sa NF-kB apan gipauswag ang pagbugkos sa DNA sa NF-kB sa nucleus.141 Pagpaaktibo sa NF-kB pinaagi sa pagkadaot nga may kalabotan sa oksihenasyon sa IkB moresulta sa pagpaaktibo sa daghang mga antioxidant nga depensa nga may kalabutan nga mga gene. Ang NF-kB nag-regulate sa pagpahayag sa daghang mga gene nga miapil sa immune response, sama sa IL-1b, IL-6, tumor necrosis factor-a, IL-8, ug daghang mga molekula sa adhesion.142,143 Ang NF-kB usab nag-regulate sa angiogenesis ug pagdaghan ug pagkalahi sa mga selula.
Ang AP-1 gi-regulate usab sa redox state. Sa presensya sa H2O2, ang pipila ka mga ion nga metal mahimong mag-aghat sa pagpaaktibo sa AP-1. Ang pagtaas sa ratio sa GSH / GSSG nagpalambo sa AP-1 nga pagbugkos samtang ang GSSG nagpugong sa pagbugkos sa DNA sa AP-1.144 nga pagbugkos sa DNA sa Fos / Jun heterodimer gipataas pinaagi sa pagkunhod sa usa ka gitipigan nga cysteine sa DNA-binding domain sa matag usa ang mga protina, 145 samtang ang DNA binding sa AP-1 mahimong pugngan sa GSSG sa daghang matang sa selula, nga nagsugyot nga ang disulphide bond formation pinaagi sa cysteine residues makapugong sa AP-1 DNA binding.146,147 Signal transduction pinaagi sa oxidative stress gisumada sa Figure 2.
MGA KASABUTAN
Ang tensiyon sa oxidative mahimong mutungha gikan sa sobrang produksiyon sa ROS pinaagi sa mga metabolikong reaksyon nga naggamit ug oksiheno ug nagbalhin sa balanse tali sa oxidant/antioxidant mga kahimtang nga pabor sa mga oxidant. Ang ROS gihimo sa mga kalihokan sa cellular metabolic ug mga hinungdan sa kalikopan, sama sa mga pollutant sa hangin o aso sa sigarilyo. Ang ROS kay reaktibo kaayo nga mga molekula tungod sa wala magkapares nga mga electron sa ilang estraktura ug nag-react sa daghang biological nga macromolecules sa cell, sama sa carbohydrates, nucleic acids, lipids, ug proteins, ug giusab ang ilang mga gimbuhaton. Ang ROS nakaapekto usab sa pagpahayag sa daghang mga gene pinaagi sa pag-upregulation sa redox-sensitive transcription nga mga hinungdan ug chromatin remodeling pinaagi sa pag-usab sa histone acetylation/deacetylation. Ang regulasyon sa redox state hinungdanon alang sa cell viability, activation, proliferation, ug organ function.
mga pakisayran
1. Valko M, Rhodes CJ, Moncol J, Izakovic M, Mazur M. Free radicals, metals ug antioxidants sa oxidative stress-induced cancer. Chem Biol Interact. 2006;160:1–40.
2. Halliwell B, Gutteridge JMC. Libre nga Radikal sa Biology ug Medisina. ika-3 nga ed. New York: Oxford University Press; 1999.
3. Marnett LJ. Lipid peroxidationdDNA kadaot sa malondialdehyde. Mutat Res. 1999;424:83–95.
4. Siems WG, Grune T, Esterbauer H. 4-Hydroxynonenal formation atol sa ischemia ug reperfusion sa gamay nga tinai sa ilaga. �Kinabuhi Sci. 1995;57:785–789.
5. Stadtman ER. Ang papel sa mga oxidant species sa pagkatigulang. Curr Med Chem. 2004;11:1105–1112.
6. Wang MY, Dhingra K, Hittelman WN, Liehr JG, deAndrade M, Li DH. Ang lipid peroxidation-induced putative malondialdehyde'DNA adducts sa mga tisyu sa dughan sa tawo. Cancer Epidemiol Biomarkers Prev. 1996;5:705–710.
7. Jenner P. Oxidative stress sa Parkinson's disease. Ann Neurol. 2003;53: S26�S36.
8. Lyras L, Cairns NJ, Jenner A, Jenner P, Halliwell B. Usa ka pagsusi sa oxidative nga kadaot sa mga protina, lipid, ug DNA sa utok gikan sa mga pasyente nga adunay Alzheimer's disease. J Neurochem. 1997;68:2061–2069.
9. Sayre LM, Smith MA, Perry G. Chemistry ug biochemistry sa oxidative stress sa neurodegenerative nga sakit. Curr Med Chem. 2001;8:721–738.
10. Toshniwal PK, Zarling EJ. Ebidensya alang sa dugang nga lipid peroxidation sa multiple sclerosis. Ang Neurochem Res. 1992;17:205–207.
11. Dhalla NS, Temsah RM, Netticadan T. Papel sa oxidative stress sa cardiovascular nga mga sakit. J Hypertens. 2000;18:655–673.
12. Kasparova S, Brezova V, Valko M, Horecky J, Mlynarik V, et al. Pagtuon sa oxidative stress sa usa ka modelo sa ilaga sa chronic brain hypoperfusion. Neurochem Int. 2005;46:601–611.
13. Kerr S, Brosnan MJ, McIntyre M, Reid JL, Dominiczak AF, Hamilton CA. Ang produksiyon sa superoxide anion nadugangan sa usa ka modelo sa genetic hypertension: papel sa endothelium. Hypertension. 1999;33:1353–1358.
14. Kukreja RC, Hess ML. Ang oxygen free-radical nga sistema: gikan sa mga equation pinaagi sa mga interaksyon sa lamad sa protina hangtod sa kadaot sa cardiovascular ug proteksyon. Cardiovasc Res. 1992;26:641–655.
15. Asami S, Manabe H, Miyake J, Tsurudome Y, Hirano T, et al. Ang pagpanigarilyo nagpahinabog pagtaas sa kadaot sa oxidative DNA, 8-hydroxydeoxyguanosine, sa sentro nga lugar sa baga sa tawo. Carcinogenesis. 1997;18:1763–1766.
16. Andreadis AA, Hazen SL, Comhair SA, Erzurum SC. Oxidative ug nitrosative nga mga panghitabo sa hika. Libre nga Radic Biol Med. 2003;35:213–225.
17. Comhair SA, Ricci KS, Arroliga M, Lara AR, Dweik RA, et al. Correlation sa systemic superoxide dismutase deficiency sa airflow obstruction sa hika. Am J Respir Crit Care Med. 2005;172:306–313.
18. Comhair SA, Xu W, Ghosh S, Thunnissen FB, Almasan A, et al. Superoxide dismutase inactivation sa pathophysiology sa asthmatic airway remodeling ug reactivity. Si J Pathol. 2005;166:663–674.
19. Dut R, Dizdar EA, Birben E, Sackesen C, Soyer OU, Besler T, Kalayci O. Oxidative stress ug ang mga determinant niini sa mga agianan sa hangin sa mga bata nga adunay hika. Alerdyi. 2008;63:1605–1609.
20. Ercan H, Birben E, Dizdar EA, Keskin O, Karaaslan C, et al. Oxidative stress ug genetic ug epidemiologic determinants sa oxidant injury sa childhood asthma. J Allergy Clin Immunol. 2006;118:1097–1104.
21. Fitzpatrick AM, Teague WG, Holguin F, Yeh M, Brown LA. Grabi nga Asthma Research Program. Ang airway glutathione homeostasis giusab sa mga bata nga adunay grabe nga hika: ebidensya sa stress sa oxidant. J Allergy Clin Immunol. 2009;123:146–152.
22. Miller DM, Buettner GR, Aust SD. Transition metals isip catalysts sa "autoxidation" nga mga reaksyon. Libre nga Radic Biol Med. 1990;8:95–108.
23. Dupuy C, Virion A, Ohayon R, Kaniewski J, D�me D, Pommier J. Mekanismo sa hydrogen peroxide formation nga gi-catalyzed sa NADPH oxidase sa thyroid plasma membrane. J Biol Chem. 1991;266:3739–3743.
24. Granger DN. Papel sa xanthine oxidase ug granulocytes sa kadaot sa ischemiareperfusion. Am J Physiol. 1988;255:H1269�H1275.
25. Fenton HJH. Oxidation sa tartaric acid sa atubangan sa puthaw. Si J Chem Soc. 1984;65:899–910.
26. Haber F, Weiss JJ. Ang catalytic decomposition sa hydrogen peroxide pinaagi sa iron salts. Proc R Soc Lond Ser A. 1934;147:332�351.
27. Liochev SI, Fridovich I. Ang Haber Weiss nagbisikleta 70 ka tuig ang milabay: usa ka alternatibong panglantaw. Redox Rep. 2002;7:55—57.
28. Klebanoff SJ. Myeloperoxidase: higala ug kaaway. J Leukoc Biol. 2005;77:598–625.
29. Whiteman M, Jenner A, Halliwell B. Hypochlorous acid-induced base modifications sa nahilit nga calf thymus DNA. Chem Res Toxicol. 1997;10:1240–1246.
30. Kulcharyk PA, Heinecke JW. Ang hypochlorous acid nga gihimo sa myeloperoxidase system sa mga phagocytes sa tawo nag-aghat sa mga covalent cross-link tali sa DNA ug protina. Biochemistry. 2001;40:3648–3656.
31. Brennan ML, Wu W, Fu X, Shen Z, Song W, et al. Usa ka sugilanon sa duha ka kontrobersiya: ang paghubit sa papel sa peroxidases sa nitrotyrosine formation sa vivo gamit ang eosinophil peroxidase ug myeloperoxidasedeficient nga mga ilaga, ug ang kinaiya sa peroxidase-generated reactive nitrogen species. J Biol Chem. 2002;277:17415–17427.
32. Denzler KL, Borchers MT, Crosby JR, Cieslewicz G, Hines EM, et al. Ang halapad nga eosinophil degranulation ug peroxidase-mediated oxidation sa airway proteins dili mahitabo sa usa ka mouse ovalbumin-challenge model sa pulmonary inflammation. J Immunol. 2001;167:1672–1682.
33. van Dalen CJ, Winterbourn CC, Senthilmohan R, Kettle AJ. Nitrite isip substrate ug tigpugong sa myeloperoxidase. Mga implikasyon alang sa nitrasyon ug paghimo sa hypochlorous acid sa mga lugar sa panghubag. J Biol Chem. 2000;275:11638–11644.
34. Wood LG, Fitzgerald DA, Gibson PG, Cooper DM, Garg ML. Ang lipid peroxidation nga gitino sa plasma isoprostanes adunay kalabotan sa kagrabe sa sakit sa malumo nga hika. Mga lipid. 2000;35:967–974.
35. Montuschi P, Corradi M, Ciabattoni G, Nightingale J, Kharitonov SA, Barnes PJ. Dugang nga 8-isoprostane, usa ka timaan sa oxidative stress, sa exhaled condensate sa mga pasyente sa asthma. Am J Respir Crit Care Med. 1999;160:216–220.
36. Simbahan DF, Pryor WA. Free-radical chemistry sa aso sa sigarilyo ug ang makahilo nga implikasyon niini. Panglantaw sa Panglawas sa Kalibutan. 1985;64:111–126.
37. Hiltermann JT, Lapperre TS, van Bree L, Steerenberg PA, Brahim JJ, ug uban pa. Ozone-induced nga panghubag nga gisusi sa sputum ug bronchial lavage fluid gikan sa asthmatics: usa ka bag-ong noninvasive nga himan sa epidemiologic nga mga pagtuon sa polusyon sa hangin ug hika. Libre nga Radic Biol Med. 1999;27:1448–1454.
38. Nightingale JA, Rogers DF, Barnes PJ. Epekto sa inhaled ozone sa exhaled nitric oxide, pulmonary function, ug induced sputum sa normal ug asthmatic nga mga subject. Thorax. 1999;54:1061–1069.
39. Cho AK, Sioutas C, Miguel AH, Kumagai Y, Schmitz DA, et al. Redox nga kalihokan sa airborne particulate matter sa lain-laing mga dapit sa Los Angeles Basin. Kalibutan Res. 2005;99:40–47.
40. Comhair SA, Thomassen MJ, Erzurum SC. Differential induction sa extracellular glutathione peroxidase ug nitric oxide synthase 2 sa mga agianan sa hangin sa himsog nga mga indibidwal nga naladlad sa 100% O (2) o aso sa sigarilyo. Am J Respir Cell Mol Biol. 2000;23:350–354.
41. Matthay MA, Geiser T, Matalon S, Ischiropoulos H. Oxidant-mediated nga kadaot sa baga sa acute respiratory distress syndrome. Crit Care Med. 1999;27:2028–2030.
42. Biaglow JE, Mitchell JB, Held K. Ang kamahinungdanon sa peroxide ug superoxide sa X-ray nga tubag. Int J Radiat Oncol Biol Phys. 1992;22:665–669.
43. Chiu SM, Xue LY, Friedman LR, Oleinick NL. Ang copper ion-mediated sensitization sa nuclear matrix attachment sites sa ionizing radiation. Biochemistry. 1993;32:6214–6219.
44. Narayanan PK, Goodwin EH, Lehnert BE. Ang mga partikulo sa alpha nagsugod sa biolohikal nga paggama sa superoxide anion ug hydrogen peroxide sa mga selula sa tawo. Cancer Res. 1997;57:3963–3971.
45. Tuttle SW, Varnes ME, Mitchell JB, Biaglow JE. Pagkasensitibo sa mga kemikal nga oxidant ug radiation sa CHO cell lines kulang sa oxidative pentose cycle nga kalihokan. Int J Radiat Oncol Biol Phys. 1992;22: 671–675.
46. Guo G, Yan-Sanders Y, Lyn-Cook BD, Wang T, Tamae D, et al. Manganese
superoxide dismutase-mediated gene expression sa radiation nga gipahinabo
mapahiangay nga mga tubag. Mol Cell Biol. 2003;23:2362–2378.
47. Azzam EI, de Toledo SM, Spitz DR, Gamay nga JB. Oxidative metabolismo
modulates signal transduction ug micronucleus formation sa bystander
mga selula gikan sa a-particle irradiated normal nga fibroblast sa tawo. Cancer Res.
2002;62:5436–5442.
48. Leach JK, Van Tuyle G, Lin PS, Schmidt-Ullrich R, Mikkelsen RB.
Ionizing radiation-induced, mitochondria-dependent nga henerasyon sa reaktibo
oxygen/nitrogen. Cancer Res. 2001;61:3894–3901.
49. Dent P, Yacoub A, Fisher PB, Hagan MP, Grant S. MAPK nga mga agianan sa
mga tubag sa radiation. Oncogene. 2003;22:5885–5896.
50. Wei SJ, Botero A, Hirota K, Bradbury CM, Markovina S, et al. Thioredoxin
Ang nukleyar nga translocation ug pakig-uban sa redox factor-1 nagpalihok sa AP-1 transcription factor isip tubag sa ionizing radiation. Cancer Res. 2000;60:6688–6695.
51. Cadet J, Douki T, Gasparutto D, Ravanat JL. Oxidative kadaot sa DNA: pagporma, pagsukod ug biochemical bahin. Mutat Res. 2003;531:5–23.
52. Yokoya A, Cunniffe SM, O'Neill P. Epekto sa hydration sa induction sa strand breaks ug base lesions sa plasmid DNA films pinaagi sa gammaradiation. J Am Chem Soc. 2002;124:8859–8866.
53. Janssen YM, Van Houten B, Borm PJ, Mossman BT. Mga tubag sa cell ug tissue sa kadaot sa oxidative. Lab Invest. 1993;69:261–274.
54. Iwanaga M, Mori K, Iida T, Urata Y, Matsuo T, et al. Nuclear factor kappa B dependent induction sa gamma glutamylcysteine synthetase pinaagi sa ionizing radiation sa T98G human glioblastoma cells. Libre nga Radic Biol Med. 1998;24:1256–1268.
55. Stohs SJ, Bagchi D. Oxidative mekanismo sa toxicity sa metal ions. Libre nga Radic Biol Med. 1995;18:321–336.
56. Leonard SS, Harris GK, Shi X. Metal-induced oxidative stress ug signal transduction. Libre nga Radic Biol Med. 2004;37:1921–1942.
57. Shi H, Shi X, Liu KJ. Oxidative nga mekanismo sa arsenic toxicity ug carcinogenesis. Mol Cell Biochem. 2004;255:67–78.
58. Pi J, Horiguchi S, Sun Y, Nikaido M, Shimojo N, Hayashi T. Usa ka potensyal nga mekanismo alang sa pagkadaot sa nitric oxide formation tungod sa dugay nga oral exposure sa arsenate sa mga rabbits. Free Radic Biol Med.2003;35:102—113.
59. Rin K, Kawaguchi K, Yamanaka K, Tezuka M, Oku N, Okada S. Ang mga break sa DNAstrand nga gipahinabo sa dimethylarsinic acid, usa ka metabolite sa inorganic nga arsenics, kusog nga gipauswag sa mga radikal nga superoxide anion. Biol Pharm Bull. 1995;18:45–58.
60. Waalkes MP, Liu J, Ward JM, Diwan LA. Mga mekanismo nga nagpahipi sa arsenic carcinogenesis: sobrang pagkasensitibo sa mga ilaga nga naladlad sa dili organikong arsenic sa panahon sa pagmabdos. Toxicology. 2004;198:31–38.
61. Schiller CM, Fowler BA, Woods JS. Epekto sa arsenic sa pyruvate dehydrogenase activation. Panglantaw sa Panglawas sa Kalibutan. 1977;19:205–207.
62. Monterio HP, Bechara EJH, Abdalla DSP. Ang pag-apil sa mga libre nga radical sa neurological porphyrias ug pagkahilo sa tingga. Mol Cell Biochem. 1991;103:73–83.
63. Tripathi RM, Raghunath R, Mahapatra S. Ang tingga sa dugo ug ang epekto niini sa lebel sa Cd, Cu, Zn, Fe ug hemoglobin sa mga bata. Kinatibuk-ang Kalibutan sa Sci. 2001;277:161–168.
64. Nehru B, Dua R. Ang epekto sa dietary selenium sa lead neurotoxicity. J Environ Pathol Toxicol Oncol. 1997;16:47–50.
65. Reid TM, Feig DI, Loeb LA. Mutagenesis pinaagi sa metal-induced oxygen radicals. Panglantaw sa Panglawas sa Kalibutan. 1994;102(suppl 3):57–61.
66. Kinnula VL, Crapo JD. Ang superoxide dismutase sa baga ug mga sakit sa baga sa tawo. Am J Respir Crit Care Med. 2003;167:1600–1619.
67. Kinnula VL. Pagprodyus ug pagkadaot sa mga metabolite sa oksiheno sa panahon sa makapahubag nga mga estado sa baga sa tawo. Ang Curr Drug Target nga Makapahubag sa Allergy. 2005;4:465–470.
68. Zelko IN, Mariani TJ, Folz RJ. Superoxide dismutase multigene nga pamilya: usa ka pagtandi sa CuZn-SOD (SOD1), Mn-SOD (SOD2), ug EC-SOD (SOD3) nga mga istruktura sa gene, ebolusyon, ug ekspresyon. Libre nga Radic Biol Med. 2002;33:337–349.
69. Kirkman HN, Rolfo M, Ferraris AM, Gaetani GF. Mga mekanismo sa pagpanalipod sa catalase pinaagi sa NADPH. Kinetics ug stoichiometry. J Biol Chem. 1999;274:13908–13914.
70. Floh� L. Glutathione peroxidase. Batakang Kinabuhi Sci. 1988;49:663–668.
71. Arthur JR. Ang glutathione peroxidases. Cell Mol Kinabuhi Sci. 2000;57:1825–1835.
72. Chu FF, Doroshow JH, Esworthy RS. Pagpahayag, kinaiya, ug pag-apod-apod sa tisyu sa usa ka bag-ong cellular selenium-dependent glutathione peroxidase, GSHPx-GI. J Biol Chem. 1993;268:2571–2576.
73. Comhair SA, Bhathena PR, Farver C, Thunnissen FB, Erzurum SC. Extracellular glutathione peroxidase induction sa asthmatic lungs: ebidensya alang sa redox regulation sa ekspresyon sa human airway epithelial cells. FASEB J. 2001;15:70�78.
74. Gromer S, Urig S, Becker K. Ang sistema sa thioredoxin gikan sa siyensya ngadto sa klinika. Med Res Pin. 2004;24:40–89.
75. Kinnula VL, Lehtonen S, Kaarteenaho-Wiik R, Lakari E, P��kk� P, et al. Ang piho nga ekspresyon sa selula sa peroxiredoxins sa baga sa tawo ug sarcoidosis sa pulmonary. Thorax. 2002;57:157–164.
76. Dubuisson M, Vander Stricht D, Clippe A, Etienne F, Nauser T, et al. Ang peroxiredoxin 5 sa tawo usa ka peroxynitrite reductase. FEBS Lett. 2004;571:161–165.
77. Holmgren A. Antioxidant function sa thioredoxin ug glutaredoxin system. Antioxid Redox Signal. 2000;2:811–820.
78. Dickinson DA, Forman HJ. Glutathione sa depensa ug pagsenyas: mga leksyon gikan sa gamay nga thiol. Ann NY Acad Sci. 2002;973:488–504.
79. Sies H. Glutathione ug ang papel niini sa cellular functions. Libre nga Radic Biol Med. 1999;27:916–921.
80. Ladner JE, Parsons JF, Rife CL, Gilliland GL, Armstrong RN. Parallel evolutionary pathways alang sa glutathione transferases: istruktura ug mekanismo sa mitochondrial class kappa enzyme rGSTK1-1. Biochemistry. 2004;43:52–61.
81. Robinson A, Huttley GA, Booth HS, Board PG. Ang pagmodelo ug bioinformatics nga mga pagtuon sa human kappa class glutathione transferase nagtagna sa usa ka nobela nga ikatulo nga transferase nga pamilya nga adunay homology sa prokaryotic 2-hydroxychromene-2-carboxylate isomerases. Biochem J. 2004;379:541–552.
82. Jakobsson PJ, Morgenstern R, Mancini J, Ford-Hutchinson A, Persson B. Komon nga mga bahin sa estruktura sa MAPEGda kaylap nga superfamily sa lamad nga may kalabutan nga mga protina nga adunay hilabihan nga nagkalainlain nga mga gimbuhaton sa eicosanoid ug glutathione metabolism. Protina Sci. 1999;8:689–692.
83. Hayes JD, Pulford DJ. Ang glutathione S-transferase supergene nga pamilya: regulasyon sa GST ug ang kontribusyon sa isoenzymes sa cancer chemoprotection ug drug resistance. Crit Rev Biochem Mol Biol. 1995;30:445–600.
84. Armstrong RN. Istruktura, mekanismo sa catalytic, ug ebolusyon sa glutathione transferases. Chem Res Toxicol. 1997;10:2–18.
85. Hayes JD, McLellan LI. Ang glutathione ug glutathione-dependent nga mga enzyme nagrepresentar sa usa ka co-ordinately regulated nga depensa batok sa oxidative stress. Libre nga Radic Res. 1999;31:273–300.
86. Sheehan D, Meade G, Foley VM, Dowd CA. Structure, function ug evolution sa glutathione transferases: mga implikasyon alang sa klasipikasyon sa mga nonmammalian nga mga miyembro sa usa ka karaang enzyme superfamily. Biochem J. 2001;360:1–16.
87. Cho SG, Lee YH, Park HS, Ryoo K, Kang KW, ug uban pa. Ang Glutathione S-transferase Mu modulates sa stress activated signals pinaagi sa pagsumpo sa apoptosis signal-regulating kinase 1. J Biol Chem. 2001;276:12749–12755.
88. Dorion S, Lambert H, Landry J. Ang pagpaaktibo sa p38 signaling pathway pinaagi sa heat shock naglakip sa dissociation sa glutathione S-transferase Mu gikan sa Ask1. J Biol Chem. 2002;277:30792—30797.
89. Adler V, Yin Z, Fuchs SY, Benezra M, Rosario L, et al. Regulasyon sa JNK signaling pinaagi sa GSTp. EMBO J. 1999;18:1321�1334.
90. Manevich Y, Feinstein SI, Fisher AB. Ang pagpaaktibo sa antioxidant enzyme 1-CYS peroxiredoxin nanginahanglan glutathionylation nga gihusay sa heterodimerization nga adunay pGST. Proc Natl Acad Sci US A. 2004;101:3780â3785.
91. Bunker VW. Free radicals, antioxidants ug pagkatigulang. Med Lab Sci. 1992;49:299–312.
92. Mezzetti A, Lapenna D, Romano F, Costantini F, Pierdomenico SD, et al. Systemic oxidative stress ug ang relasyon niini sa edad ug sakit. J Am Geriatr Soc. 1996;44:823–827.
93. Puti E, Shannon JS, Patterson RE. Ang relasyon tali sa bitamina ug
paggamit sa calcium supplement ug colon cancer. Cancer Epidemiol Biomarkers Prev. 1997;6:769–774.
94. Masella R, Di Benedetto R, Vari R, Filesi C, Giovannini C. Mga mekanismo sa nobela sa natural nga antioxidant compound sa biological nga mga sistema: pagkalambigit sa glutathione ug glutathione-related enzymes. J Nutr Biochem. 2005;16:577–586.
95. Curello S, Ceconi C, Bigoli C, Ferrari R, Albertini A, Guarnieri C. Mga pagbag-o sa status sa cardiac glutathione human sa ischemia ug reperfusion. Experientia. 1985;41:42–43.
96. El-Agamey A, Lowe GM, McGarvey DJ, Mortensen A, Phillip DM, Truscott TG. Carotenoid radical chemistry ug antioxidant/pro-oxidant nga mga kabtangan. Arch Biochem Biophys. 2004;430:37–48.
97. Rice-Evans CA, Sampson J, Bramley PM, Holloway DE. Ngano nga nagpaabut kita nga ang mga carotenoid mahimong mga antioxidant sa vivo? Libre nga Radic Res. 1997;26:381–398.
98. Niles RM. Mga agianan sa signal sa retinoid chemoprevention ug pagtambal sa kanser. Mutat Res. 2004;555:81–96.
99. Donato LJ, Noy N. Pagpugong sa pagtubo sa mammary carcinoma pinaagi sa retinoic acid: ang proapoptotic nga mga gene mao ang mga target alang sa retinoic acid receptor ug cellular retinoic acid-binding protein II signaling. Cancer Res. 2005;65:8193–8199.
100. Niizuma H, Nakamura Y, Ozaki T, Nakanishi H, Ohira M, et al. Ang Bcl-2 usa ka yawe nga regulator alang sa retinoic acid-induced apoptotic cell death sa neuroblastoma. Oncogene. 2006;25:5046–5055.
101. Dalton TP, Shertzer HG, Puga A. Regulasyon sa ekspresyon sa gene pinaagi sa reaktibo nga oxygen. Ann Rev Pharmacol Toxicol. 1999;39:67–101.
102. Scandalios JG. Genomic nga mga tubag sa oxidative stress. Sa: Meyers RA, ed. Encyclopedia sa Molecular Cell Biology ug Molecular Medicine. Tomo 5. 2nd ed. Weinheim, Alemanya: Wiley-VCH; 2004: 489–512.
103. Ghosh R, Mitchell DL. Epekto sa kadaot sa oxidative DNA sa mga elemento sa tigpasiugda sa pagbugkos sa transcription factor. Mga Nucleic Acids Res. 1999;27:3213–3218.
104. Marietta C, Gulam H, Brooks PJ. Ang usa ka 8, 50-cyclo-20-deoxyadenosine nga samad sa usa ka TATA box nagpugong sa pagbugkos sa TATA binding protein ug kusog nga pagkunhod sa transkripsyon sa vivo. Pag-ayo sa DNA (Amst). 2002;1:967–975.
105. Jackson AL, Chen R, Loeb LA. Induction sa microsatellite instability
pinaagi sa oxidative DNA kadaot. Proc Natl Acad Sci US A. 1998;95:12468�12473.
106. Caldecott KW. Ang mga interaksyon sa protina-protina sa panahon sa mammalian DNA single-strand break repair. Biochem Soc Trans. 2003;31:247–251.
107. Cooke MS, Evans MD, Dizdaroglu M, Lunec J. Oxidative DNA kadaot: mekanismo, mutation, ug sakit. FASEB J. 2003;17:1195�1214.
108. Jones PL, Wolffe AP. Mga relasyon tali sa organisasyon sa chromatin ug DNA methylation sa pagtino sa ekspresyon sa gene. Semin Cancer Biol. 1999;9:339–347.
109. Girotti AW. Mga mekanismo sa lipid peroxidation. J Free Radic Biol Med. 1985;1:87–95.
110. Siu GM, Draper HH. Metabolismo sa malonaldehyde sa vivo ug in vitro. Mga lipid. 1982;17:349–355.
111. Esterbauer H, Koller E, Slee RG, Koster JF. Posible nga pag-apil sa lipid-peroxidation nga produkto 4-hydroxynonenal sa pagporma sa fluorescent chromolipids. Biochem J. 1986;239:405–409.
112. Hagihara M, Nishigaki I, Maseki M, Yagi K. Ang mga pagbag-o nga nagsalig sa edad sa lebel sa lipid peroxide sa mga tipik sa lipoprotein sa serum sa tawo. J Gerontol. 1984;39:269–272.
113. Keller JN, Mark RJ, Bruce AJ, Blanc E, Rothstein JD, ug uban pa. 4- Hydroxynonenal, usa ka aldehydic nga produkto sa membrane lipid peroxidation, nagdaot sa glutamate transport ug mitochondrial function sa synaptosomes. Neuroscience. 1997;806:85–96.
114. Uchida K, Shiraishi M, Naito Y, Torii Y, Nakamura Y, Osawa T. Pagpaaktibo sa stress signaling pathways pinaagi sa katapusan nga produkto sa lipid peroxidation. Ang 4-hydroxy-2-nonenal usa ka potensyal nga inducer sa paghimo sa intracellular peroxide. J Biol Chem. 1999;274:2234–2242.
115. Suc I, Meilhac O, Lajoie-Mazenc I, Vandaele J, Jurgens G, Salvayre R, Negre-Salvayre A. Pagpaaktibo sa EGF receptor pinaagi sa oxidized LDL. FASEB J. 1998;12:665�671.
116. Tsukagoshi H, Kawata T, Shimizu Y, Ishizuka T, Dobashi K, Mori M. 4-Hydroxy-2-nonenal nagpalambo sa produksiyon sa fibronectin pinaagi sa IMR-90 nga mga fibroblast sa baga sa tawo nga bahin pinaagi sa pagpaaktibo sa epidermal growth factor receptor-linked extracellular signal- regulated kinase p44/42 nga agianan. Toxicol Appl Pharmacol. 2002;184:127–135.
117. Montuschi P, Collins JV, Ciabattoni G, Lazzeri N, Corradi M, Kharitonov SA, Barnes PJ. Gipagawas ang 8-isoprostane isip in vivo biomarker sa lung oxidative stress sa mga pasyente nga adunay COPD ug himsog nga mga hinabako. Am J Respir Crit Care Med. 2000;162:1175–1177.
118. Morrison D, Rahman I, Lannan S, MacNee W. Epithelial permeability, panghubag, ug stress sa oxidant sa mga kahanginan sa mga hinabako. Am J Respir Crit Care Med. 1999;159:473–479.
119. Nowak D, Kasielski M, Antczak A, Pietras T, Bialasiewicz P. Dugang nga sulod sa thiobarbituric acid-reaktibo nga mga butang ug hydrogen peroxide sa expired gininhawa condensate sa mga pasyente nga adunay lig-on nga chronic obstructive pulmonary nga sakit: walay mahinungdanong epekto sa pagpanigarilyo. Respirar Med. 1999;93:389–396.
120. Kelly FJ, Mudway IS. Ang oksihenasyon sa protina sa interface sa hangin-baga. Amino Acid. 2003;25:375–396.
121. Dean RT, Roberts CR, Jessup W. Fragmentation sa extracellular ug intracellular polypeptides pinaagi sa free radicals. Prog Clin Biol Res. 1985;180:341–350.
122. Keck RG. Ang paggamit sa t-butyl hydroperoxide isip probe alang sa methionine oxidation sa mga protina. Anal Biochem. 1996;236:56–62.
123. Davies KJ. Ang kadaot sa protina ug pagkadaot sa mga radical sa oxygen. I. Kinatibuk-ang mga aspeto. J Biol Chem. 1987;262:9895–9901.
124. Stadtman ER. Metal ion-catalyzed oxidation sa mga protina: biochemical nga mekanismo ug biological nga mga sangputanan. Libre nga Radic Biol Med.
1990;9:315–325.
125. Fucci L, Oliver CN, Coon MJ, Stadtman ER. Ang pagpaaktibo sa yawe nga metabolic enzymes pinaagi sa mixed-function oxidation reactions: posible nga implikasyon sa protina turnover ug pagkatigulang. Proc Natl Acad Sci US A. 1983;80:1521�1525.
126. Stadtman ER, Moskovitz J, Levine RL. Oxidation sa methionine residues sa mga protina: biological nga mga sangputanan. Antioxid Redox Signal. 2003;5:577–582.
127. Stadtman ER, Levine RL. Free radical-mediated oxidation sa libre nga amino acids ug amino acid residues sa mga protina. Amino Acid. 2003;25:207–218.
128. Stadtman ER. Ang oksihenasyon sa protina sa pagkatigulang ug mga sakit nga may kalabutan sa edad. Ann NY Acad Sci. 2001;928:22–38.
129. Shacter E. Pag-ihap ug kamahinungdanon sa oksihenasyon sa protina sa biological nga mga sample. Drug Metab Pin. 2000;32:307–326.
130. Poli G, Leonarduzzi G, Biasi F, Chiarpotto E. Oxidative stress ug cell signaling. Curr Med Chem. 2004;11:1163–1182.
131. Neufeld G, Cohen T, Gengrinovitch S, Poltorak Z. Vascular endothelial growth factor (VEGF) ug ang mga receptor niini. FASEB J. 1999;13:9–22.
132. Sundaresan M, Yu ZX, Ferrans VJ, Sulciner DJ, Gutkind JS, et al. Regulasyon sa reactive-oxygen species nga henerasyon sa fibroblasts ni Rac1. Biochem J. 1996;318:379â382.
133. Sun T, Oberley LW. Redox nga regulasyon sa transcriptional activators. Libre nga Radic Biol Med. 1996;21:335–348.
134. Klatt P, Molina EP, De Lacoba MG, Padilla CA, Martinez-Galesteo E, Barcena JA, Lamas S. Redox nga regulasyon sa c-Jun DNA nga nagbugkos pinaagi sa mabalik nga S-glutathiolation. FASEB J. 1999;13:1481�1490.
135. Reynaert NL, Ckless K, Guala AS, Wouters EF, van der Vliet A, Janssen Heininger
YM. In situ detection sa S-glutathionylated proteins human sa glutaredoxin-1 catalyzed cysteine derivatization. Biochim Biophys Acta. 2006;1760:380–387.
136. Reynaert NL, Wouters EF, Janssen-Heininger YM. Modulasyon sa glutaredoxin-1
ekspresyon sa usa ka modelo sa mouse sa allergic airway disease. Am J Respir Cell Mol Biol. 2007;36:147–151.
137. Filomeni G, Rotilio G, Ciriolo MR. Cell signaling ug ang glutathione redox system. Biochem Pharmacol. 2002;64:1057–1064.
138. Pande V, Ramos MJ. Molecular recognition sa 15-deoxydelta (12,14) prostaglandin J(2) pinaagi sa nuclear factor-kappa B ug uban pang cellular proteins. Bioorg Med Chem Lett. 2005;15:4057–4063.
139. Perkins ND. Paghiusa sa mga agianan sa pagsenyas sa cell nga adunay function sa NF-kappaB ug IKK. Nat Rev Mol Cell Biol. 2007;8:49–62.
140. Gilmore TD. Pasiuna sa NF-kappaB: mga magdudula, mga agianan, mga panan-aw. Oncogene. 2006;25:6680–6684.
141. Hirota K, Murata M, Sachi Y, Nakamura H, Takeuchi J, Mori K, Yodoi J. Lahi nga mga tahas sa thioredoxin sa cytoplasm ug sa nucleus. Usa ka duha ka lakang nga mekanismo sa redox nga regulasyon sa transcription factor NF-kappaB. J Biol Chem. 1999;274:27891�27897.
142. Purok PA. Papel sa komplemento, chemokines ug regulatory cytokines sa acute nga kadaot sa baga. Ann NY Acad Sci. 1996;796:104–112.
143. Akira S, Kishimoto A. NF-IL6 ug NF-kB sa cytokine gene regulation. Adv Immunol. 1997;65:1–46.
144. Meyer M, Schreck R, Baeuerle PA. Ang H2O2 ug antioxidants adunay kaatbang nga mga epekto sa pagpaaktibo sa NF-kappa B ug AP-1 sa mga intact cells: AP-1 isip secondary antioxidant-responsive factor. EMBO J. 1993;12:2005�2015.
145. Abate C, Patel L, Rausher FJ, Curran T. Redox regulasyon sa fos ug jun DNA-pagbugkos nga kalihokan sa vitro. Siyensya. 1990;249:1157–1161.
146. Galter D, Mihm S, Droge W. Lahi nga mga epekto sa glutathione disulphide sa nukleyar nga transcription nga mga hinungdan kB ug ang activator protein-1. Eur J Biochem. 1994;221:639–648.
147. Hirota K, Matsui M, Iwata S, Nishiyama A, Mori K, Yodoi J. Ang kalihokan sa transkripsyon sa AP-1 gikontrol sa direktang asosasyon tali sa thioredoxin ug Ref-1. Proc Natl Acad Sci US A. 1997;94: 3633�3638.
Propesyonal nga Sakop sa Pagpraktis *
Ang kasayuran dinhi sa "El Paso, TX Oxidative Stress ug Antioxidant Defense" wala gituyo nga pulihan ang usa-sa-usa nga relasyon sa usa ka kwalipikado nga propesyonal sa pag-atiman sa kahimsog o lisensyado nga doktor ug dili tambag medikal. Giawhag ka namon nga maghimo mga desisyon sa pag-atiman sa kahimsog base sa imong panukiduki ug pakigtambayayong sa usa ka kwalipikado nga propesyonal sa pag-atiman sa kahimsog.
Impormasyon sa Blog ug Kasangkaran nga mga Panaghisgot
Ang among sakup sa kasayuran limitado sa Chiropractic, musculoskeletal, pisikal nga mga tambal, kaayohan, nga nag-amot sa etiological mga kasamok sa viscerosomatic sulod sa mga klinikal nga presentasyon, kaubang somatovisceral reflex clinical dynamics, subluxation complex, sensitibo nga mga isyu sa panglawas, ug/o functional nga mga artikulo sa medisina, mga hilisgutan, ug mga diskusyon.
Among gihatag ug present klinikal nga kolaborasyon uban sa mga espesyalista gikan sa lainlaing mga disiplina. Ang matag espesyalista gidumala sa ilang propesyonal nga sakup sa praktis ug ilang hurisdiksyon sa lisensya. Gigamit namon ang mga protocol sa kahimsog ug kahimsog aron matambal ug suportahan ang pag-atiman sa mga kadaot o sakit sa musculoskeletal system.
Ang among mga video, mga post, mga hilisgutan, mga hilisgutan, ug mga insight naglangkob sa mga klinikal nga butang, mga isyu, ug mga hilisgutan nga may kalabutan ug direkta o dili direkta nga nagsuporta sa among klinikal nga sakup sa praktis.*
Ang among opisina makatarunganon nga misulay sa paghatag suporta nga mga citation ug nahibal-an ang may kalabutan nga pagtuon sa panukiduki o mga pagtuon nga nagsuporta sa among mga post. Naghatag kami mga kopya sa pagsuporta sa mga pagtuon sa panukiduki nga magamit sa mga board sa pagdumala ug publiko kung gihangyo.
Nasabtan namon nga gisakup namon ang mga butang nga nanginahanglan dugang nga pagpatin-aw kung giunsa kini makatabang sa usa ka piho nga plano sa pag-atiman o protokol sa pagtambal; busa, aron sa dugang nga paghisgot sa hilisgutan sa taas, palihug ayaw pangutana Dr. Alex Jimenez, DC, O kontaka kami sa 915-850-0900.
Ania kami aron matabangan ka ug ang imong pamilya.
Panalangin
Dr. Alex Jimenez D.C., MSACP, RN*, CCST, Ang IFMCP*, CIFM*, ATN*
email: coach@elpasofunctionalmedicine.com
Lisensyado isip Doktor sa Chiropractic (DC) sa Texas & New Mexico*
Lisensya sa Texas DC # TX5807, New Mexico DC Lisensya # NM-DC2182
Lisensyado isip Rehistradong Nars (RN*) in Florida
Lisensya sa Florida nga RN Lisensya # RN9617241 (Kontrol No. 3558029)
Compact nga kahimtang: Multi-State License: Gitugotan sa Pagpraktis sa Mga Estado sa 40*
Alex Jimenez DC, MSACP, RN* CIFM*, IFMCP*, ATN*, CCST
Akong Digital Business Card